Большая Энциклопедия Нефти и Газа. Цинковый электрод
Цинковые электроды изготовление - Справочник химика 21
Активность цинковых электродов, изготовленных посредством электролиза импульсным током с большой скважностью значительно превышает активность электродов, приготовленных двумя другими способами. Наименьшей активностью, как и следовало ожидать, обладают электроды, изготовленные непосредственно из перфорированной цинковой фольги. [c.314]Работоспособность цинковых электродов, изготовленных различными способами, при отрицательных температурах была проверена на макетах сухозаряженных серебряно-цинковых аккумуляторов емкостью 0,6 а - ч, в которых положительные электроды изготовлялись предварительным формированием спрессованных из серебряного порошка брикетов 119]. Макеты заливали электролитом и после суточной пропитки разряжали в камере холода при соответствующей температуре. Перед тем как поместить аккумуляторы в камеру холода при помощи вольтметра с внутренним сопротивлением 1 ком измерялась их э. д. с. [c.315]
Производство сухих марганцево-цинковых элементов включает следующие основные операции изготовление положительного электрода, изготовление цинкового электрода, приготовление [c.29]Для выполнения работы рекомендуются аккумуляторы СЦК-3, СЦС-3, СЦС-5 или СЦС-12. Аккумуляторы большей емкости неудобны, так как потребуют значительных токов в режимах форсированного разряда. В качестве СК-аккумулятора можно использовать макет, изготовленный на основе СЦ-акку-мулятора, в котором цинковые электроды заменены на прессованные кадмиевые. [c.234]
Приготовить 1,0 и 0,1т водные растворы сульфата цинка и сульфата меди. Приготовить медные и цинковые электроды, используя стеклянные сосуды (рис. 30) для составления гальванических элементов, указанных в задании. Использовать для составления элементов насыщенный каломельный электрод промышленного изготовления (рис. 31, а) или его приготовить, Приготовление электродов описано ниже. Поместить электроды в термостат при 25° С на 10—15 мин. Поочередно в термостате составлять гальванические эле.меиты, [c.143]
Производство стаканчиковых элементов слагается из следующих операций 1) изготовление агломератов 2) изготовление цинкового электрода-сосуда 3) изготовление электролита 4) изготовление картонных и других вспомогательных деталей 5) сборка элементов и батарей. [c.557]
Галетные батареи собирают из отдельных плоских элементов. Каждый элемент содержит биполярный электрод, изготовленный из прямоугольной цинковой пластинки, на одной стороне которой нанесен электропроводный, но непроницаемый для электролита слой из смеси графита, канифоли и минерального масла. Агломерат имеет также плоскую прямоугольную форму, толщина его около [c.559]
Фактическая емкость порошкового цинкового электрода СЦ-аккумулятора равна 3,5 А-ч. Коэффициент использования цинка в электроде 65 %. Потери активной массы при изготовлении электродов 2 %. [c.62]
Для предотвращения коррозии металлических конструкций, находящихся в почве, таких как металлические трубопроводы, резервуары, сваи, опоры, применяется электрохимическая катодная защита. Ее осуществляют путем подсоединения металлической конструкции к отрицательному полюсу внешнего источника постоянного тока, положительный полюс присоединяют к заземленному металлическому электроду, который постепенно разрушается. При этом на поверхности защищаемого металла протекают восстановительные процессы, а окисляется материал анода. Другой метод электрохимической защиты основан на присоединении защищаемого металла к электроду, изготовленному из более активного металла. При защите стальных конструкций применяют цинковые пластины. В этой гальванической паре цинк будет разрушаться и защищать сталь от коррозии. Отсюда и название этого метода —метод протектора (от лат. рго ес/ог —покровитель). Например, для защиты от коррозии к корпусам морских кораблей прикрепляют цинковые пластины. [c.149]
Изготовление вспомогательных металлических деталей специфично для каждого источника тока. Основные металлические детали цинковые стаканы- стальные корпуса и токоотводы электродов являются частью электродов. Изготовление таких деталей рассматривается совместно с технологией изготовления электродов. [c.132]
Из-за значительного смещения угольного стержня от центр и нарушения вследствие этого центровки электрода в элементе при работе источника тока возможно одностороннее срабатывание цинкового электрода м преждевременный выход источника тока из строя. Поэтому качество центровки влияет на срок службы элемента и контролируется при изготовлении агломерата. [c.140]
Отрицательный электрод галетного элемента состоит из цинковой пластины с нанесенным на нее с одной стороны электропроводным слоем. С Другой стороны на электроде располагают диафрагму. Диафрагма помещается на электрод не при сборке элемента, а во время изготовления цинкового электрода, поэтому изготовление и нанесение диафрагмы технологически связаны с операциями изготовления отрицательного электрода. [c.169]
Все операции заключаются в изготовлении и нанесении электропроводного слоя на цинковые листы, изготовлении диафрагм со слоем загущенного электролита, приклеивании диафрагм к цинковым листам и штамповке отрицательных электродов. [c.170]
Расскажите об изготовлении цинковых электродов солевых стаканчиковых элементов. [c.213]
Изготовление цинкового электрода заключается в приготовлении цинковых опилок, штамповке и гальваническом лужении стальной крышки, запрессовке цинковых опилок в крышку, пропитке запрессованного цинка в электролите, амальгамации цинка. [c.234]
Рассмотрим устройство и работу пресс-формы для изготовления отрицательных электродов. На рис. 210 показана пресс-форма для запрессовки цинковых опилок. Через обойму 3 пресс-формы цинковые опилки 4 засыпают в крышку элемента 5 и запрессовывают до упора пуансоном 1 за один ход поршня пресса без выдержки при промежуточном положении. Высота цинкового электрода зависит от толщины прокладки 2. После прессования пресс-форму снимают с пресса и разбирают. Обойму 3 с пуансоном поднимают, а крышку с запрессованным цинком вынимают из основания 6. Затем в основание 6 вставляют следующую крышку, надевают обойму 3, в нее засыпают порцию цинковых опилок, вставляют пуансон 1 и операцию повторяют. [c.259]
Для изготовления элемента Вольта нужна пластинка из амальгамированного цинка. Тщательно очистить поверхность цинковой пластинки наждачной бумагой, промыть водой, а затем спиртом и снова водой. Положить пластинку в ванну с раствором соли ртути на 5—10 мин (работы с солями ртути проводить на специальном противне). Промыть цинковый электрод водой и закрепить на одной из стенок батарейного стакана. На противоположной стенке подвесить очищенную медную пластинку. Налить в стакан 1 н. раствор серной кислоты. Присоединить вольтметр с небольшим потреблением тока. Что при этом наблюдается Написать уравнения реакций, происходящих на электродах. Зачем цинковая пластинка амальгамируется Чему равна электродвижущая сила данного элемента Какие еще гальванические элементы применяются [c.81]
Способы изготовления цинковых электродов. Электрод, имеющий вид коробки, может быть изготовлен пайкой, вытягиванием, сваркой или заливкой. [c.72]
Пайка является самым старым и до настоящего времени распространенным способом изготовления цинковых электродов. Цинковые листы в этом случае нарезают на рольных и гильотинных ножницах на карточки, соответствующие размеру электрода. Далее каждую карточку изгибают на прессе, образуя боковые стенки электрода. Цилиндрические электроды выгибают из карточек иа специальных ( пулеметных ) станках. Донышки изготовляют отдельно штамповкой. [c.72]
В последнее время появились новые методы изготовления цинковых электродов. Советскими инженерами созданы автоматы большой производительности, осуществляющие электросварку шва крупных цинковых электродов. Наряду с изготовлением мелких электродов методом вытягивания этот способ имеет большие перспективы для своего развития при производстве крупных эле-ментов. [c.73]
Цинковый электрод щелочно-цинкового аккумулятора изготовлен из смеси, содержащей 7,1 г ZnO, улучшающие присадки и связующее. После некоторого циклирования при полном заряде электрода примерно 97% окиси цинка переходит в металлическое состояние. Непрерывно циклирующий электрод обладает разрядной емкостью 3,27 А-ч. После продолжительного бездействия в заряженном состоянии при повышенной температуре электрод отдал емкость 2,02 А-ч. Разряженная активная масса такого электрода содержала. 1,96 г металлического цинка. [c.63]
Рассмотрим Б качестве примера медно-цинковый гальванический элемент, работающий за счет энергии приведенной выше реакции между цинком и сульфатом меди (рис. 82). Этот элемент (элемент Якоби — Даниэля) состоит из медной пластины, погруженной в раствор сульфата меди (медный электрод), и цинковой пластины, погруженной в раствор сульфата цинка (цинковый электрод). Оба раствора соприкасаются друг с другом, но для предупреждения смешивания они разделены перегородкой, изготовленной из пористого материала. [c.265]
В последние годы разработаны и выпускаются также стаканчиковые элементы набивного типа. Они рассчитаны на более жесткие режимы работы. В Советском Союзе по набивной технологии выпускаются элементы типа Сатурн . На рис. 5 показаны различные образцы элементов стаканчиковой конструкции, изготовленных по набивной технологии. В элементах, изображенных на рис. 5, а, цинковый электрод представляет собой тонкий цилиндр, положенный в стальной стакан, дно и крышка элемента также стальные. Корпус элемента снаружи покрыт парафинированной бумагой. [c.23]
Сборочные операции выполняются автоматом для изготовления корпусов элементов — бумажных обечаек и пятью ротационными автоматами, служащими для вставки и завальцовки крышки в бумажную обечайку, для прессования электропроводного стакана, для вставки цилиндра из агломератной массы в корпус, для вставки цинкового электрода и для заливки парафино-канифольной композиции в газовую камеру элемента, вставки, завальцовки и приварки донышка к цинковому электроду. Указанные ротационные автоматы соединены друг с другом при помощи синхронно работающих механизмов, передающих изделия с автомата на автомат. [c.112]
Существует взаимосвязь между активностью цинкового электрода при цементировании кадмия из раствора, величиной потенциала при анодной поляризации и работоспособностью аккумуляторов при низкой температуре (табл. 70). Например, электрод, изготовленный посредством электролиза цинкатного электролита импульсным током с большой скважностью, при использовании в качестве катода перфорированной цинковой фольги имеет большую активность при цементации, высокий потенциал при поляризации током плотностью 40 ма1см и обладает лучшей работоспособностью при отрицательных температурах. Наоборот, цинковый электрод, изготовлен- [c.317]
Пассивация цинкового электрода происходит при обычных температурах уже при плотности тока 10—12 а дм , а при пониженных температурах (до +5 С) —при 6—7 а/дм . Для устранения быстрой пассивации наиболее целесообразно применять металлокерамические илн намазные электроды, изготовленные из цинкового порошка с добавкой раэличных связующих, а также оцинкованные медные сетки. [c.881]
Изготовление отрицательного электрода. Для обеспечения необходимой коррозионной стойкости цинка, соприкасающегося в сухих элементах с электролитом, он не должен содержать примесей, образующих вредные короткозамкнутые пары. Поэтому обычно применяют металл, содержащий не менее 99,94% цинка. Примеси металлов, перенапряжение водорода на которых велико, не оказывают вредного влияния. Иногда даже рекомендуется применять цинк, содержащий 0,3% Сё и 0,3% РЬ, так как кадмий повышает ко ррозионную стойкость цинка, а свинец облегчает при прокатке получение металла с более равномерной структурой. Устойчивость цинка заметно возрастает в присутствии ртути. Поэтому в производстве цинковых электродов их, как правило, подвергают амальгамированию. [c.33]
Указания для лаборантов. Электроды готовят следующим образом. Проволочку нз соответствующего металла (Ад, Си, N1) с припаянным к ней выводом помещают в стеклянную трубку, которую заполняют пицеином (герметизирующая замазка из пчелиного воска и очищенного дегтя). Такап конструкция надежно изолирует место контакта от действия атмосферного воздуха. При изготовлении кадмиевого, свинцового и цинкового электродов стеклянную трубку заполняют не пицепном, а соответствующим расплавленным металлом. [c.61]
В никель-цинковом аккумуляторе использованы ме-таллокерамические оксидно-никелевые электроды, изготовленные пропиткой в растворе азотнокислого никеля с последующей обработкой в щелочи. С такими электродами при не очень тщательной обработке в электролит могут быть занесены нитраты, которые подвергаются редокс-превращениям (нитрат нит- [c.67]
Основным конструктивным материалом при изготовлении галетных марганцево-цинковых элементов является поливинилхлоридная пленка, обтягивающая и скрепляющая в единый узел агломерат, диафрагму и цинковый электрод. Ее изготовляют в виде трубки разного диаметра. Диаметр трубки выбирается с учетом габаритов элементов. Для небольших галетных элементов прр1ме-няется трубка с длиной полукольца (т. е. половиной длины окружности) 8,5—9,5 мм и толщиной 0,2 мм. [c.128]
Цилиндрические цинковые -стаканы изготовляют без шва экструзионным способом. Этот способ заключется в изготовлении цинкового электрода ударом, длящимся менее секунды. [c.155]
Жало готового к работе паяльника должно быть равномерно залужено применяемым для пайки припоем ПОС-30 (ГОСТ 1499—70). Правильно подготовленный к работе паяльник имеет бестящее жало без черных участкон окислов. Паяльником набирается припой. Пайку бокового шва и донышка производят при вращении вокруг своей оси оправки с надетой согнутой заготовкой и вставленным донышком. Нельзя пользоваться во время пайки оправками, изготовленными из железа, меди и ее сплавов, так как в случае протекания оловянно-свинцового припоя на внутреннюю-поверхность спаиваемого цинкового стакана возможно прочное соединение материала оправки с цинковым электродом. На рис. 124 изображены места пайки швов цинковых стаканов. Швы после пайки должны быть герметичными. Герметичность всех корпусов проверяется работницей просмотром на свету. В местах пайки не должно быть наростов выступов припоя, а внутри цинкового стакана— крошки припоя. Внутренняя поверхность электрода должна быть блестящей без следов юкисления. Размеры спаянных цинковых электродов проверяются штангенциркулем или специально предназначенным шаблоном. [c.168]
Золочение изделий, изготовленных из меди и латуни, а также стальных омедненных или латунированных деталей, можно осуществить с применением пористой диафрагмы и цинкового контакта. Цинковый электрод помещают в анолит-концентрированный раствор поваренной соли, а покрываемое изделие в католит следующего состава (г/л) золото в виде гремучего золота 1,2 железнстосинеро-дистый натрий (кристаллогидрат) 15,0. фосфат натрия двухзамещен-ный (кристаллогидрат) 7,5, углекислый натрий 4,0, сульфат натрия 0,15, температура раствора 70 С, продолжительность процесса [c.86]
В воздушно-цинковых элементах окислителем вместо относительно дорогих оксидов металлов служит О3 воздуха, к-рый участвует в р-ции на электроде, изготовленном из каталитически активного угля. Спеа отверстие в крышке обеспечивает своб. доступ воздуха к электроду. Отсутствне заложенного запаса окислителя обеспечивает высокие значения уд. энергии-до 250 Вт-ч/кг. Недостатки этих элементов-небольшое значение разрядного тока и сравнительно быстрый саморазряд что обусловлено взаимод. щелочного электролита с окружающей атмосферой. В результате электролит высыхает либо взаимод. с [c.498]
Серебряно-цинковый элемент (СЦЭ). Применение этой системы в наливных резервных элементах устраняет ряд недостатков СЦ-аккумуляторов отпадает необходимость в тщательном подборе материала диафрагмы, разделяющей электродные пространства, что позволяет заметно снизить внутреннее сопротивление источника можно применять очень тонкие электроды, что повышает удельные характеристики источника, особенно во время эксплуатации при коротктгх режимах разряда. Элементы данной системы хранят обычно отдельно от электролита, заливают электролит непосредственно перед использованием элемента с помощью сжатого воздуха или особых устройств, Большое внимание при разработке таких элементов уделяется цинковому электроду, пассивация которого в условиях обычных температур происходит уже при плотности тока 10— 12 А/дм , а при пониженных температурах (+5°С)—при 6—7 А/дм1 Чтобы устранить быструю пассивацию цинка, целесообразно применять металлокерамические или намазные электроды, изготовленные из цинкового порошка с добавкой различных связующих, а также использовать в качестве электродов оцинкованные медные сетки. [c.415]
В описанных элементах с момента их изготовления электролит находится в соприкосновении с электродами. Поэтому при хранении в них всегда наблюдается постепенное разъедание цинка, ведущее к саморазряду. Неоднократно предлагалось изменить конструкции набивно го и мешкового- элементов таким образом, чтобы до включения их в работу электролит был изолирован от цинкового электрода. [c.55]
Производство сухих элементов с двуокисью марганца состоит из следующих основных операций 1) изготовления положительного электрода, 2) изготовления отрицательного (цинкового) электрода, 3) приготовления электролита и 4) сборки элементов. Кроме того, производство сухих элементов связано с подсобными процессами, к которым относятся изготовление футляров, реофоров, латунных колпачков, варка смолки и т. п. [c.61]
Изготовление отрицательного электрода. Отрицательный (цинковый) электрод сухого элемента обычно иредставляет собой коробку квадратного или круглого сечения. Сохранность элемента в такой же степени зависит от качества цинкового электрода, в какой емкость элемента зависит от качества агломерата. [c.71]
При изготовлении элементов для анодных батарей и батарей для карманных фонариков нашел широкое применение способ вытягивания мелких цинковых электродов цилиндрической формы. В этом случае из толстых листов цинка, содержащего в качестве примеси не больше 1 % свинца, штампуют круглые заготовки, так называемые пятачки . После специальной обработки (шлифовки, обезжиривания, нажиривания и подогрева) эти пятачки вытягивают на мощных прессах с помощью соответствующей матрицы и пуансона. В заключение верхний край заготовки обрезают на особом станке, после чего электрод приобретает стандартные размеры. [c.73]
Наконец, следует обратить внимание, что технологический процесс изготовления галетных батарей проще, чем производство баларей старого типа. В этом случае многие операции, как обвязка агломератов, вытягивание цинковых электродов и др., целиком выпадают из производственного цикла. [c.80]
Большое внимание при разработке таких элементов уделялось цинковому электроду, пассивация которого при обычных температурах происходит уже при плотности тока 10—12 а/дм , а при пониженных температурах (+5° С) — при 6—7 а1дм . Из многих предложенных методов устранения быстрой пассивации путем увеличения истинной поверхности электрода наиболее приемлемым оказалось применение металлокерамических или намазных электродов, изготовленных из цинкового порошка с добавкой различных связующих, а также применение в качестве электродов оцинкованных медных сеток. [c.36]
chem21.info
Электрод цинковый - Справочник химика 21
Одним из наиболее простых гальванических элементов является элемент Даниэля, или элемент Якоби, состоящий из двух электродов — цинкового и медного, погруженных в соответствующие растворы сульфатов цинка и меди, которые разделены пористой перегородкой (рис. 5.6). Цинковый электрод заряжается отрицательно по отношению к медному. [c.179] Составьте схему, напишите уравнения электродных и суммарной реакций (при Т = 298 К> и элемента, у которого один из электродов цинковый е [c.221]При постоянном давлении водорода потенциал водородного электрода — функция только активности ионов водорода, т. е. функция pH раствора. При = 1 моль/л, / н, ==1атм потенциал водородного электрода равен нулю. Поэтому в паре с любым другим электродом он образует. элемент, ЭДС которого равна потенциалу этого электрода. При этом знак потенциала электрода совпадает со знаком заряда этого электрода. Например, если соединить с таким нормальным водородным электродом цинковый электрод, активность ионов цинка в котором 1 моль/л, то получим гальванический элемент с ЭДС = 0,763 В, причем цинковый электрод отрицательный — , а водородный положительный Н- (электроны движутся от цинкового электрода к водородному). Таким образом, водородный электрод может служить электродом сравне- [c.301]
В системе двух электродов, цинкового и водородного, устанавливаются равновесия на водородном. .., на цинковом. ... [c.104]
Принадлежности для работы. Аккумулятор реохорд гальванометр нормальный кадмиевый элемент однополюсный переключатель двухполюсный переключатель два выключателя каломельный электрод цинковый электрод медный электрод водородный электрод медные провода кристаллический хингидрон. [c.69]
Несмотря на симметрическую конструкцию нашего гальванического элемента, роль - материалов, из которых он сделан, различна. Один электрод(цинковый) является непосредственным участником реакции, питающей гальванический элемент своей энергией. Другой электрод (свинцовый) играет роль лишь передатчика электронов и может быть заменен без какого бы то ни" было изменения в действии элемента другим подходящим проводником, даже неметаллическим (графит). То же относится и к растворам цинковой соли. [c.627]
Зная потенциал каломелевого электрода (см. табл. на стр. 121), вычислить потенциал каждого электрода (цинкового и медного в соответствующем растворе его соли). [c.125]
Если изолировать одну половину установки рис. У-29, например стакан А, то в месте соприкосновения электрода (цинковой пластинки) с раствором гпЗО , установится равновесие между атомами и ионами цинка 2п 2п" 2е. Положительные ионы будут находиться в растворе, а электроны в самой пластинке. Вследствие этого прилегающий к электроду слой раствора зарядится положительно, а сам электрод — [c.206]
Для работы требуется. Приборы (см. рис. 62, 63 или 60 и 64).—Амперметр на 5 ампер. — Аккумулятор на 6—8 вольт. — Вольтметр на 5 вольт. — Реостат ползунковый. — Ключ электрический. — Электрод медный. — Электрод цинковый. — Сосуд пористый. — Песочная баня. — Тигель железный. — У-образ-ная трубка. — Термометр на 100 °С. — Ступка фарфоровая. — Штатив с пробирками. — Стакан химический емк. 300—400 мл. — Стакан химический емк. [c.178]
Определите понятие стандартный электродный потенциал и выделите наиболее существенные моменты метода измерения стандартного электродного потенциала для Zn + (водн.) 2п (тв.)-электрода. Цинковый и угольный электроды (рис. 13.13) частично погружены в водный раствор гидроксида калия. Некоторая часть 2п (тв.) переходит в раствор в виде цинкат-иона ЪпО (водн.). [c.321]
Си 0,0003-0,01 324,7 ДФС-10. Дуга (220 В, 6 А), проба — анод, подставной электрод — цинковый стержень 0 08-10 мм, заточен на крышу , межэлектродное расстояние — 1,8 мм. Интегрирование — 80 с [c.727]
На рис. 16-3 показана зависимость количества полония, осажденного на электроде из хрома, от времени. Поверхность электрода 1 см , объем раствора 20 мл. Точка А, соответствующая резкому увеличению количества выделенного полония, отвечает обработке поверхности электрода цинковой проволокой. [c.160]
Пайка является самым старым и до настоящего времени распространенным способом изготовления цинковых электродов. Цинковые листы в этом случае нарезают на рольных и гильотинных ножницах на карточки, соответствующие размеру электрода. Далее каждую карточку изгибают на прессе, образуя боковые стенки электрода. Цилиндрические электроды выгибают из карточек иа специальных ( пулеметных ) станках. Донышки изготовляют отдельно штамповкой. [c.72]
Фирмой Кеу-о-Уас освоен выпуск галетных батарей оригинальной конструкции. На одной стороне широкой ленты укрепляют цинковый электрод, а под ним с другой стороны — марганцовый электрод, рядом монтируют элемент с обратным расположением электродов цинковый — снизу, а агломерат — сверху и т. д. Затем весь ряд элементов закрывают второй половиной ленты и полученный таким образом пояс собирают [c.28]
Принципиально для конструирования гальванического элемента и яревращения убыли изобарно-изотермического потенциала — ДОг лри электрохимическом процессе в электрическую форму энергии можно использовать любую окислительно-восстановительную реакцию ионного типа. Рассмотрим работу никелево-цинкового (N1—2п) гальванического элемента (см. рис. 27). Электрический ток в нем возникает вследствие окислительного процесса, протекающего на границе Zn — раствор, содержащий ион Zп + (на цинковом электроде), и восстановительного на границе N1 — раствор, содержащий ионы N 2+ (на никелевом электроде). Цинковая и никелевая пластинки, опущенные в растворы своих солей, посылают в раствор разное количество ионов. Прн установившемся равновесии разность потенциалов на границах 2п — раствор и N1 — раствор по величине ле равна одна другой. Поверхность цинка имеет больший отрицательный заряд, чем поверхность никеля. Цинк обладает большей способностью посылать свои ионы в раствор, чем никель. При процессе 2п = 2п +-Ь2е —ЛОт больше, чем —АСг при процессе N1 = = Ы12+-(-2( . Когда цинковую пластинку с никелевой соединяют -проводником первого рода — медью, электроны с цинка перетекают а никель. Равновесие двойного электрического слоя на никелевом электроде нарушается, электродный процесс принимает обратное направление, иоиы N1 + из раствора переходят на никелевую пластинку. Нарушенное равновесие восстанавливается за счет того, что в раствор поступает новая порция ионов Zn + и разряжается эквивалентное число ионов N1 +. Снова возникает разное количество зарядов на цинковой и никелевой пластинках и переход электронов и т. д. В итоге на цинковом электроде протекает окислительный процесс Zп = Zп2+-t-2e(Zn). Электроны от цинковой пластинки переходят к никелевой 2e(Zn)- 2e(Ni). На никелевом электроде идет восстановительный процесс N +- -26(Ni) = N1. Запись пе(Ме) указывает, что электроны остаются в металле. [c.124]
Подготовка. Растворы (1н.) сульфатов меди и цинка. Электрод медный. Электрод цинковый (в виде пластинок). Стакан емкостью 500—600 мл. Пористый глиняный цилиндр (диаметр около 5 см). Вольтметр на 5 б (демонстрационный). [c.106]
Пример. Гальванический элемент Даниэля — Якоби (рис. 63) состоит из цинкового электрода — цинковая пластина, погруженная в раствор сульфата цинка(П), и медного электрода — медная пластина, пбгруженная в раствор сульфата меди(П) [c.216]
Вспомним принцип работы гальванических элементов, уже рассмотренный в курсе неорганической химии. Простейший гальванический элемент получается, если цинковую и медную пластинки погрузить в растворы их солей (разделенные диафрагмой) и соединить электроды металлическим проводником. Появление в цепи электрического тока обусловливается при этом окислительно-восстановительными процессами, происходящими на электродах. Цинковая пластинка гальванического элемента частично растворяется, и катионы переходят в раствор, а оставшиеся на пластинке электроны сообщают ей отрицательный заряд. Поэтому процесс, происходящий на цинковом электроде (аноде), можно изобразить уравнением [c.110]
Батарея на основе этой системы собиралась из элементов с биполярными электродами. Цинковые листы толщиной 0,2 мм покрывались с одной стороны серебряным [c.118]
Рабочий процесс сборки начинается укладкой агломерата в кассету. Агломераты поступают на участок сборки галетных элементов в виде стопок, уложенных в ящики. Цепная передача 38 через валик с водилом 37 и мальтийский крест 25 приводит в действие барабан агломератного узла 23, имеющий на поверхности гнезда, в которые поступают агломераты из питателя. Агломераты подаются к питателю в пеналах 22. Барабан подает агломераты к узлу опускания агломератов 24, работающему от кулака 39 и укладывающему агломерат в кассету. Прижимные рамки, находящиеся в кассетах, перед укладкой агломерата удаляются выталкивателем рамок 20, движущимся также с помощью кулака 39. Это объясняется тем, что узел опускания агломерата и выталкиватель рамок смонтированы в одном узле и имеют общий рычаг 40. Прижимные рамки, удаленные из кассет, подаются шибером 18, работающим от кулака 19, в направляющие переброски рамок 27. Кассеты с уложенными в них агломератами по направляющим подаются к узлу резки и укладки бумаги. Бумага подается к узлу в рулонах. С бобины 51 бумага протягивается клещами 48 на нужную длину, отрезается ножницами 52 и затем укладчиком 50 досылается в кассету. Узел приводится в движение цилиндрической зубчатой передачей 45. Далее кассеты поступают к месту укладки прижимных рамок, которые перед поступлением агломерата в кассету были удалены и поданы в направляющие переброски рамок. Из этих направляющих прижимные рамки опускаются в кассеты укладчиком 53. Затем кассеты подаются к узлу укладки цинковых электродов. Цинковые карточки подаются к узлу так же, как и агломераты, в пеналах 46. Из пенала по вертикальному подвижному бункеру карточки поступают к верхним и нижним зажимам 54, работающим по копирам 55. Нижние зажимы захватывают один нижний электрод, верхние зажимы — некоторое количество остальных цинковых карточек, которые затем приподнимаются вместе с бункером. Отделенный нижний электрод освобождается от зажимов и шибером 56 подается из-под бункера в плавающие направляющие, установленные над кассетой, откуда толкателем 57 укладывается [c.218]
Наиболее простая установка для электрохимического испытания защитных свойств лакокрасочных покрытий (рис. 66) состоит из двух электродов — цинкового анода 1 и покрытого испытуемым лаком железного катода 2, опущенных в стакан 3 со стандартным нейтральным электролитом — 3 %-ным раствором КС1. В таких условиях в основном происходит ионизация цинка на аноде и деполяризация железного катода растворенным кислородом, сопровождающаяся ионизацией кислорода. [c.273]
Составьте схему, напишите уравнения электродных и суммарной реакций и рассчитайте ЭДС элемента, у которого один электрод цинковый с активностью [c.275]
Рассмотрим работу элемента Якоби (рис. 65)—одного из наиболее простых и наиболее старых гальванических элементов, состоящего из двух электродов—цинкового и медного, погруженных в соответствующие растворы сульфатов цинка и меди, которые разделены пористой перегородкой. Цинковый электрод заряжается отрицательно по отношению к медному электроду, и когда при их замыкании по гальванической цепи проходит ток, то на медном электроде осаждается медь, а цинковый электрод растворяется. Электродвижущая сила и вызванный ею ток [c.150]
Марганцово-цинковый элемент. Из всех применяемых в настоящее время гальванических элементов марганцово-цинковые наиболее распространены. Имеется неско.пько разновидностей элементов этой системы, но в основе действия их всех лежит окислительно-восстановительная реакция между цинком и диоксидом марганца. В элементах этой системы один электрод цинковый, другой состоит из Мп02- Оба электрода находятся в растворе хлорида аммония. [c.681]
Составьте схему, напишите уравнения электродных процессов и суммарной реакции и рассчитайте для 298 К э. д. с. элемента, у которого один электрод цинковый с Дхпг-ь = моль/л, а второй — водородный при стандартном давлении водорода и pH 2. Ответ Е = 0,70 В. [c.400]
Медно-цинковый гальванический элемент состоит из двух электродов цинковой пластины, погруженной в раствор 2п504, и медной пластины, погруженной в раствор СиЗО . Если соединить металлические пластины проволокой или растворы солей электролитическим ключом , начнется движение электронов от цинковой пластины к медной, т. е. будет протекать окислительно-восстановительный процесс. [c.87]
Составьте схему, напишите урапиения электродных процессов и суммарной реакции элемента, у которого один электрод цинковый с а и = [c.221]
Если изолировать одну половину показанной на рнс. V-11 установки, папример стакан Л, то в мосте соприкосновения электрода (цинковой пластинки) с раствором ZnS04 установится равновьсне между атомами и нонами цинка Zn Zn" + 9.е . Положительные ионы будут находиться в растворе, а электроны в самой пластинке. Вследствие этого прилегающий к электроду слон раствора зарядится положительно,, а сам электрод — отрицательно н между ними установится разность потенциалов. Подобное же явление бз дст иметь место п в отдельно взятом стакане Б с тем лищь отличием, что значение разности потенциалов будет иное. Очевидно, что если бы удалось его измерить, была бы количественно охарактеризована тенденция ионов того или иного металла ii переходу в раствор. [c.163]
О том, как построить электролитическую цепь или гальванический элемент, сказано в 10.5 (см. рис. 10.7). Рассмотрим еще один пример гальванического элемента, который состоит из стандартных цинкового и никелевого электродов (цинковая и никелевая пластинки погружены в 1 М растворы 2п504 и N 504 соответственно). Схему элемента можно записать так [c.207]
Несмотря на симметрическую конструкцию нащего гальванического элемента, роль материалов, из которых он сделан, различна. Один электрод (цинковый) является непосредственным участникам реакций, пи- тающей гальванический элемент своей энергией. Другой электрод (евин-цовый) играет роль лишь передатчика электроио и может быть заме- 5 ней без какого бы то ни было изменеиия в действии элемента другим [c.452]
Потенциал цинка относительно медносульфатного электрода составляет —1100 мв (—750 мв по водородному электроду). Цинковый протектор не может понизить потенциал железа ниже —900 же (по медносульфатному электроду). Этот потенциал в областях, непосредственно близких к протектору, может повредить, например, окраску корабля. К. п. д. протектора достигает 95% при емкости 750 а ч1кг. Появление отложений на протекторах можно предотвратить применением по возможности наиболее чистого цинка (99,99%) или цинка с добавками магния. Особенно нежелательны в цинке примеси железа, являющегося причиной сильного падения токоотдачи. Примеси железа не должны превышать 0,0015% [25]. [c.800]
Катодное отделение установки для внутреннего э.тектролиэа (см. рис. 19.9) содержит 50,0 мл 0,200 г-ион/л раствора Си + и медный электрод. Цинковый электрод, погруженный в 25,0 мл раствора с концентрацией 2п + 5,00-10 г-ион/л служит анодом. Сопротивление ячейки 7,5 Ом. Определите [c.32]
После восстановления всей окиси цинка, содержащейся в электроде, начинается выделение цинка за счет разряда цинкатных ионов из раствора. При этом запас этих ионов в электролите, находящемся в порах электрода, довольно быстро истощаегся. Дальнейшее выделение цинка осуществляется за счет ионов, находящихся в растворе за пределами электрода. Цинковые кристаллы начинают расти в глубь раствора, образуя древообразные цинковые дендриты, которые представляют особую опасность для аккумулятора, приводя к внутренним коротким замыканиям. По этой причине количества активных материалов в аккумуляторе выбираются в таких соотношениях, чтобы тюсле полного заряда аккумулятора в цинковом электроде оставалась избыточная окись цинка. [c.185]
Если изолировать одну половину установки рис. V-24, например стакан А, то в месте соприкосновения электрода (цинковой пластинки) с раствором ZnSO) установится равновесие между атомами и ионами цинка Zn Zrv + 2e. Положительные ионы будут находиться в растворе, а электроны в самой пластинке. Вследствие этого прилегающий к электроду слой раствора зарядится положительно, а сам электрод — отрицательно и между ними установится разность потенциалов. Подобное же явление будет иметь место и в отдельно взятом стакане Б с тем лишь отличием, что величина разности потенциалов будет иная. Очевидно, что если бы удалось ее измерить, то тем самым была бы количественно охарактеризована тенденция того или иного металла к переходу в раствор в виде ионов. [c.208]
Для работы требуется Аккумулятор на 6—8 вольт. — Амперметр на 5 ампер. — Вольтметр на 5 вольт. — Реостат ползунковый. — Ключ электрический. — Электрод медный. — Электрод цинковый. — Сосуд пористый. — Штатив с пробирками. — Стакан толстостенный. — Стаканы химические емк. 100 мл 2 шт. — Цинковая пластинка. — Железная пластинка. — Медная пластинка. — Платиновая или серебряная проволока. — Магний металлический в стружках. — Цинк гряну.пигюванный. — Медные стружки, — Сурьма в порошке.—-Двуокись свинца. — Бумага наждачная. — Сульфат меди bV раствор.— Сульфат цинка XN р-р. — Соляной кислоты IN и б /Ь-ный р-ры.— Серная кислота 2N р-р. — Хлорид магния 1/V р-р. — Хлорид марганца [c.144]
chem21.info
Цинковый электрод - Большая Энциклопедия Нефти и Газа, статья, страница 1
Цинковый электрод
Cтраница 1
Цинковый электрод в этом случае заряжен отрицательно по сравнению со стандартным водородным. [1]
Цинковый электрод можно заменить на магниевый. В этом случае в качестве электролита применяют водный раствор MgBtj. Напряжение такого элемента равно. [3]
Цинковый электрод - источник электронов, поступающих во внешнюю цепь, - принято считать отрицательным, а медный электрод - положительным. Названия электродам даются в соответствии с процессами, которые на них протекают: электрод, на котором протекает процесс окисления, называется анодом, а электрод, на котором протекает процесс восстановления, - катодом. [4]
Цинковый электрод - источник электронов, поступающих во внешнюю цепь, - принято считать отрицательным, а медный электрод - положительным. Следует различать знаки электродов и их названия. Название электродам дается в соответствии с процессами, которые на них протекают: электрод, на котором протекает процесс окисления, называется анодом, а электрод, на котором протекает процесс восстановления, называется катодом. [5]
Цинковый электрод - источник электронов, поступающих во внешнюю цепь - принято считать отрицательным, а медный электрод - положительным. Следует различать знаки электродов и их названия. [7]
Цинковый электрод в щелочных растворах обладает рядом достоинств, которые обеспечивают высокие характеристики источников тока со щелочным электролитом. [8]
Цинковый электрод образует отрицательный полюс элемента. [9]
Цинковый электрод, растворяясь, посылает в раствор ионы цинка, а ионы меди осаждаются на медном электроде. Ионы SOi движутся через пористую перегородку. [10]
Цинковые электроды, покрытые сплошным слоем окиси цинка, не могут разряжаться. Если элемент с таким электродом находится в батарее, то при разряде вместо растворения цинка на нем начинается выделение кислорода из воды, имеющейся в растворе. [11]
Цинковый электрод является отрицательным полюсом гальванического элемента, а водородный электрод - положительным полюсом. [13]
Цинковый электрод амальгамировать, для чего палочку цинка погружают на несколько секунд в раствор азотнокислой закиси ртути и затем, бчистив фильтровальной бумагой, - в металлическую ртуть. Медный электрод необходимо покрыть электролитически медью, так как потенциал электрода зависит также и от состояния поверхности. Омеднение производится в специально приготовленной ванне. [14]
Цинковый электрод является в этом элементе отрицательным, серебряный - положительным. Электроны переходят по замыкающему металлическому проводнику от цинкового электрода к серебряному. [15]
Страницы: 1 2 3 4 5
www.ngpedia.ru
Цинковый электрод - Большая Энциклопедия Нефти и Газа, статья, страница 3
Цинковый электрод
Cтраница 3
Цинковые электроды изготовляются отливкой из сплава цинк-ртуть или ( реже) из чистого цинка. В последнем случае электроды подвергают поверхностной амальгамации. [31]
Цинковый электрод в - процессе разряда растворяется с образованием ионов цинка. [33]
Цинковый электрод является растворимым, тогда как на положительном электроде РЬО2 восстанавливается до нерастворимого сульфата свинца. [35]
Цинковый электрод, конечно, необходим, так как цинк является прямым участником химической реакции, энергия которой питает элемент. Наоборот, несущественно, что в качестве второго электрода мы взяли именно медь. Этот второй электрод в химической реакции не участвует; он служит лишь передатчиком электронов, нейтрализующих ионы меди. [36]
Цинковый электрод погружен в раствор цинкового купороса, а медный - в раствор медного купороса. Два раствора разделены цилиндром из обожженной глины, который не препятствует движению ионов, но предохраняет растворы от быстрого перемешивания. При нормальной концентрации растворов электрохимический потенциал цинка равен - 0 50 В, а меди - - [ - 0 61 В. Под действием разности потенциалов между электродами электроны от цинка во внешней цепи будут перемещаться к меди. Для восстановления электрохимического потенциала цинкового электрода будет происходить дополнительный переход его положительных ионов в раствор, а восстановление электрохимического потенциала медного электрода будет сопровождаться осадком на нем положительных ионов. [38]
Цинковый электрод в щелочных растворах обладает рядом достоинств, которые обеспечивают высокие характеристики источников тока со щелочным электролитом. [39]
Цинковые электроды, покрытые сплошным слоем гидрата окиси цинка, не могут разряжаться. Если элемент с таким электродом находится в батарее, то при разряде вместо растворения цинка на нем начинается выделение кислорода из воды, имеющейся в растворе. При выделении кислорода происходит значительный сдвиг потенциала цинкового электрода в положительную сторону. При этом потенциал цинкового электрода оказывается положительнее потенциала двуокисномарганцевого электрода. Так происходит изменение полярности, то есть переполю-совка элемента в батарее при образовании сплошной пленки гидрата окиси цинка на поверхности электрода. В одиночном элементе переполюсовка никогда не происходит. [40]
Цинковые электроды без металлических донышек вставляются в футляр, так, чтобы между нижними ребрами электрода и дном футляра имелся слой битума 0 5 - 1 5 мм. Затем, медленно поворачивая и одновременно наклоняя футляр, заливают в цинковые электроды битумную композицию так, чтобы высота дна, образованного слоем битума, была 2 5 - 10 мм. После равномерного распределения и остывания композиции образуется донная часть. [41]
Цинковый электрод находится в таком положении, при котором электропроводный слой располагается, как показано на рис. 153, г, выше цинковой пластины. Все детали, помещенные в кассету, образуют галетныи элемент, подготовленный к операции затяжки в полихлорвиниловую пленку. [43]
Цинковый электрод, являющийся анодом гальванической батареи, может при работе подвергаться гальваническому и химическому растворению, а также и коррозии. Эти явления могут происходить при разомкнутой цепи. Для уменьшения растворения цинкового электрода его амальгамируют. Градуировку прибора производят пропусканием газовых смесей с различным содержанием кислорода и регистрацией показаний гальванометра. [45]
Страницы: 1 2 3 4 5
www.ngpedia.ru
Саморазряд - цинковый электрод - Большая Энциклопедия Нефти и Газа, статья, страница 1
Саморазряд - цинковый электрод
Cтраница 1
Саморазряд цинкового электрода может вызываться действием на цинк различных примесей, содержащихся в электролите. Такими примесями могут быть ионы различных металлов, более электроположительных, чем цинк. Ионы этих металлов, разряжаясь на поверхности цинка, образуют короткозамкнутые пары, в которых цинк служит анодом. [1]
Саморазряд цинкового электрода ( коррозия цинка) усиливается в случае загрязнения цинка примесями с более низким перенапряжением выделения на них водорода, например железом. Примеси же металлов, обладающих большим перенапряжением выделения водорода, чем цинк, например ртути, уменьшают скорость растворения цинка. Последним обстоятельством пользуются в производстве элементов, амальгамируя цинковые электроды. [2]
Саморазряд цинкового электрода ( коррозия цинка) усиливается в случае загрязнения цинка примесями с более низким перенапряжением выделения на них водорода, например железом. Примеси же металлов, обла - дающих большим перенапряжением выделения водорода, чем цинк, например ртути, уменьшают скорость растворения цинка. Последним обстоятельством пользуются в производстве элементов, амальгамируя цинковые электроды. [3]
Скорость саморазряда цинкового электрода заметно уменьшается после обработки его в подкисленном растворе сульфата ртути ( 5 г / л) вследствие повышения водородного перенапряжения. [4]
Вторым фактором, вызывающим саморазряд цинкового электрода, является кислород воздуха, соприкасающийся с влажной поверхностью цинка. [5]
Саморазряд серебряно-цинкового аккумулятора определяется саморазрядом цинкового электрода. Поэтому добавки в цинковый электрод металлов с высоким значением водородного перенапряжения, таких, как ртуть, свинец, олово, снижают, а с малым водородным перенапряжением, таких, как железо, повышают скорость растворения цинка. Вообще скорость растворения цинка той чистоты, которая требуется для аккумулятора, в щелочном растворе весьма незначительна. Скорость растворения реального цинкового электрода ввиду его очень большой поверхности, удельная величина которой равна примерно 0 5 м2 / г [56], существенно выше. Все же саморазряд серебряно-цинковых аккумуляторов сравнительно невелик. [6]
Саморазряд серебряно-цинкового аккумулятора определяется саморазрядом цинкового электрода. [7]
К недостаткам свинцово-цинкового элемента относят: чувствительность к температуре окружающей среды ( снижение температуры резко уменьшает разрядную емкость), обильное газовыделение при разряде из-за саморазряда цинкового электрода, а также низкая сохранность в состоянии готовности к действию. [8]
К недостаткам свинцово-цинкового элемента относятся: чувствительность к температуре окружающей среды ( снижение температуры резко уменьшает разрядную емкость), обильное газовыделение при разряде из-за саморазряда цинкового электрода, а также низкая сохранность в состоянии готовности к действию. [9]
Ингибиторами называются вещества, замедляющие скорость химической реакции, но остающиеся после реакции в том же количестве, в котором они были взяты. Для снижения саморазряда цинкового электрода в элемент вводят в качестве ингибитора двухромовокислый калий К С Ог, проводят амальгамацию цинка. Существует точка зрения, что крахмал и мука, применяемые в качестве загущающих добавок к электролиту, содержат органические вещества, проявляющие ингибирующее действие на коррозию цинка. В случае повышенной коррозии раствор электролита насыщается аммиакатом цинка [ Zn ( Nh4) 2 ] Cl2, который выпадает в виде осадка, вызывая повышенную поляризацию обоих электродов источника тока. [10]
Свинцово-цинковый элемент ( СвЦЭ) известен с середины прошлого века. Было сделано множество попыток использовать данную систему в качестве аккумулятора, однако высокий саморазряд цинкового электрода и его недостаточная обратимость привели к тому, что она нашла практическое применение только в виде мощных наливных элементов. Оба электрода могут быть изготовлены из фольги толщиной 0 02 - 0 05 мм. В других вариантах СвЦЭ в качестве положительного применяется намазной РЬО2 - элек-трод, а отрицательный представляет собой тонкие вальцованные листы амальгамированного цинка. [11]
Свинцово-цинковый элемент ( СвЦЭ) известен с середины прошлого века. Было сделано множество попыток использовать данную систему в качестве аккумулятора, однако высокий саморазряд цинкового электрода и его недостаточная обратимость привели к тому, что она нашла практическое применение только в виде мощных наливных элементов. Оба электрода могут быть изготовлены из фольги толщиной 0 02 - 0 05 мм. В других вариантах СвЦЭ в качестве положительного применяется намазкой РЬО2 - элек-трод, а отрицательный представляет собой тонкие вальцованные листы амальгамированного цинка. [12]
Образуется также коллоидный раствор серебра. Проникая к отрицательному электроду, соединения серебра восстанавливаются и отлагаются на цинке, а так как перенапряжение для выделения водорода на серебре значительно меньше, чем на 2 цинке, то это вызывает саморазряд цинкового электрода. Кроме того, серебро отлагается на цинке в виде дендритов, которые в отдельных случаях могут достичь положительного электрода и вызвать короткое замыкание. На рис. 174 изображена схема устройства серебряно-цинкового аккумулятора. Положительный и отрицательный электроды разделены несколькими слоями целлофана. В аккумуляторах, предназначенных для разрядов токами большой плотности при ограниченном сроке службы, берут 3 слоя пленки; если требуется более длительный срок службы, число слоев целлофана доводят до пяти. Положительные электроды одеты в мешочки из капроновой ткани. Проволочные токоотводы пропущены в каналы в борнах и припаяны к ним. Сосуды применяют из прозрачных пластмасс, чаще всего из полиамида или полистирола. Это позволяет следить за уровнем электролита, который заливают в аккумулятор не более чем на половину высоты. Набухший в электролите целлофан, благодаря плотной сборке, обеспечивает прохождение тока по всей высоте электродов, а избыток электролита мог бы вызвать оплывание цинковой активной массы. [14]
Коррозия с выделением газообразного водорода немного замедляется при использовании ингибиторов. Ингибиторами называются вещества, замедляющие скорость химической реакции, но остающиеся после реакции в том же количестве, в котором они были взяты. Для снижения саморазряда цинкового электрода в элемент вводят в качестве ингибитора двухромовокислый калий С О. [15]
Страницы: 1 2
www.ngpedia.ru
Цинкового электрода.
Схематическая запись элемента:
Ag|AgCl, KCl| KCl | ZnSO4 (1 M)|Zn
Для приготовления этого элемента пользуются имеющимся цинковым электродом. Хлорсеребряный электрод Ag½AgCl,KClнасыщ является электродом сравнения, его потенциал eхс = 0,203 В. Этот электрод погружают в стаканчик с насыщенным раствором KCl, отсоединяют медный электрод и сохраняют его для 3-го и 4-го заданий. Присоединив зажимы к цинковому электроду и хлорсеребряному электроду, измеряют ЭДС хлорсеребряно-цинкового гальванического элемента и записывают в таблицу3 значение Еоп в вольтах.
Вычисляют потенциал цинкового электрода, используя уравнение:
Еоп = eхс - eZn, откуда eZn = eхс - Еоп
Проверив правильность полученных результатов у преподавателя, разбирают цинковый электрод. Вынимают из электродной ячейки цинковую пластинку, зачищают её и тщательно вытирают фильтровальной бумагой. Из ячейки выливают раствор ZnSO4 и ополаскивают её дистиллированной водой. Собрав полуэлемент, помещают его в стакан для хранения цинковых полуэлементов.
Задание 3. Измерение ЭДС медно-хлорсеребряного гальванического элемента и вычисление потенциала медного электрода.
Схематическая запись элемента:
Cu|CuSO4 (1 M)| KCl | KCl, AgCl|Ag
Для составления этого элемента используют медный электрод, приготовленный в первом разделе работы, и хлорсеребряный электрод сравнения, которым уже пользовались. Измеряют ЭДС так же, как в задании 2, и записывают результат в таблицу 3.
Затем вычисляют потенциал медного электрода, используя уравнение
Еоп = eCu - eхс, откуда eCu = Еоп + eхс.
Задание 4. Измерение ЭДС медного концентрационного
Гальванического элемента
Схематическая запись элемента:
Cu|CuSO4 (1 M)| KCl | CuSO4 (0,01 M)|Cu
Для составления медного концентрационного гальванического элемента используют уже приготовленный медный электрод и второй электрод с концентрацией CuSO4 0,01 M, приготовленный так: в проточную электродную ячейку наливают до половины её объема 0,01 М раствор CuSO4, опускают в раствор медную пластинку. Оба электрода опускают в стаканчик с насыщенным раствором KCl. Присоединив зажимы, измеряют Еоп. Проверяют результат у преподавателя, записывают его в таблицу 3. Разбирают медные электроды и ставят в соответствующие концентрациям стаканы для хранения.
Задания 5,6. Измерение ЭДС окислительно-восстановитель-ной цепи и вычисление окислительно-восстановительного потенциала.
Контрольные растворы для выполнения заданий 5 и 6 получают у преподавателя.
Задание 5.
Схематическая запись элемента:
Pt| 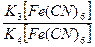 || KClнасыщ, AgCl|Ag
|| KClнасыщ, AgCl|Ag
Выливают из стаканчика насыщенный раствор KCl и ополаскивают его дистиллированной водой. В стаканчик наливают раствор, полученный у преподавателя, и опускают в него хлорсеребряный и ОВ- электроды. Подключив зажимы, измеряют ЭДС гальванического элемента и рассчитывают величину окислительно-восстановительного потенциала, используя уравнение:
Еоп = eов - eхс, откуда eов = Еоп + eхс.
Задание 6.
Схематическая запись элемента:
Pt| почва || KClнасыщ, AgCl|Ag
В стаканчик помещают образец почвы, добавляют дистиллированную воду (по заданию преподавателя) до получения однородной пастообразной массы. Опускают в образец хлорсеребряный и ОВ-электроды. Подключив зажимы, измеряют ЭДС гальванического элемента и рассчитывают величину окислительно-восстановительного потенциала почвы, используя уравнение:
Еоп = eов - eхс, откуда eов = Еоп + eхс.
Проверив правильность выполненной работы и отметив её у преподавателя, приводят в порядок рабочее место.
ДОМАШНЕЕ ЗАДАНИЕ
1. Вычислить теоретическую величину ЭДС гальванического элемента Даниеля-Якоби теоретически (Етеор):
Нормальный потенциал медного электрода e0Cu = 0,34 В.
Нормальный потенциал цинкового элетрода e0Zn = -0,76 В.
Поскольку fa,CuSO4 = fa,ZnSO4, теоретическая ЭДС элемента Даниеля-Якоби будет равна
Етеор = e0Cu - e0Zn
Вычисленную теоретическую величину ЭДС записывают в соответствующую графу табл. 3 и сравнивают её с ЭДС, найденной опытным путем. Эти величины должны отличаться не более, чем на 0,05 В.
2. Проверить правильность найденных значений электродных потенциалов медного и цинкового электродов, используя их опытные значения при вычислении ЭДС медно-цинкового гальванического элемента по уравнению
E = eCu - eZn
Сравнивают полученную величину с найденной величиной ЭДС опытным путем в первом задании. Если эти величины отличаются не более чем на 0,01 В, работа выполнена правильно.
3. Проверить правильность измерения ЭДС концентрационной цепи, вычислив теоретически ЭДС медного концентрационного элемента по уравнению
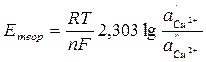
где – 2,303 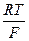 = 0,0577 + 0,0002(t –18) для любой температуры t, n – валентность ионов Cu2+; a’- активность ионов меди в 1 М растворе сульфата меди; f’- коэффициент активности ионов меди 1 М растворе сульфата меди, равный 0,041; a’’ – активность ионов меди в 0,01 М растворе сульфата меди; f’’ – коэффициент активности ионов меди в 0,01 М растворе сульфата меди, равный 0,41.
= 0,0577 + 0,0002(t –18) для любой температуры t, n – валентность ионов Cu2+; a’- активность ионов меди в 1 М растворе сульфата меди; f’- коэффициент активности ионов меди 1 М растворе сульфата меди, равный 0,041; a’’ – активность ионов меди в 0,01 М растворе сульфата меди; f’’ – коэффициент активности ионов меди в 0,01 М растворе сульфата меди, равный 0,41.
Вычисленную величину Етеор сравнивают с найденной опытным путем Еоп и, если они отличаются не более чем на 0,01 В, записывают результаты в таблицу 3.
4. Рассчитать активность окисленной формы Fе, если известна величина окислительно-восстановительного потенциала (из задания 5 или 6 по указанию преподавателя), активность восстановленной формы Fе равна 0,1, нормальный окислительно-восстановительный потенциал e0ов для данных окислителя и восстановителя равен 0,771 В.
Похожие статьи:
poznayka.org
Потенциал - цинковый электрод - Большая Энциклопедия Нефти и Газа, статья, страница 1
Потенциал - цинковый электрод
Cтраница 1
Потенциал цинкового электрода в щелочном растворе, содержащем 300 - 600 г / л КОН, равен 1 25 В. При разряде такого электрода поляризация незначительна. Коррозия цинка происходит медленно из-за высокого перенапряжения выделения водорода. [1]
Потенциал цинкового электрода в щелочном электролите равен - 1 24 в, а потенциал кадмиевого электрода в растворах серной кислоты равен - 0 40 в. Оба значения указаны по отношению к нормальному водородному электроду. Данные электроды не отличаются высокой обратимостью, но удобны для практических измерений в условиях эксплуатации аккумуляторов. [2]
Потенциал цинкового электрода зависит от ионной концентрации цинка. [3]
Потенциал цинкового электрода отрицательнее потенциала водородного электрода, поэтому возможна коррозия цинка с выделением водорода. Однако благодаря высокому перенапряжению водорода скорость его выделения и соответственно скорость коррозии цинка невелики. Для увеличения перенапряжения водорода и соответственно снижения скорости коррозии цинка последний обычно амальгамируют. [4]
Потенциал цинкового электрода отрицателен по отношению к потенциалу хлорного электрода. [6]
В этом случае потенциал цинкового электрода оказывается положительное потенциала двуокисномарганцевого электрода. В одиночном элементе переполюсовка никогда не происходит. [7]
Пусть необходимо определить потенциал цинкового электрода по водородной шкале. [8]
Как изменяется в процессе электролиза потенциал цинкового электрода, опущенного в сульфат цинка. [9]
На рис. 4 приведена схема измерения потенциала цинкового электрода относительно стандартного водородного электрода. [10]
С увеличением концентраций ОН - - ионов потенциал цинкового электрода сдвигается в отрицательную сторону, увеличиваясь по абсолютному значению. [11]
Таким образом, с уменьшением концентрации раствора потенциал цинкового электрода становится отрицательнее. [12]
Потенциал кадмиевого электрода примерно на 0 35 в положительнее потенциала цинкового электрода; по этой причине напряжение серебряно-кадмиевых аккумуляторов на такую же величину ниже напряжения серебряно-цинковых аккумуляторов. [13]
Можно показать ( доказательство здесь не приводится), что сдвиг потенциала цинкового электрода в отрицательную область понижает энергетический барьер для прямой реакции и одновременно повышает энергетический барьер для обратной реакции. Поэтому сдвиг потенциала цинкового катода в более отрицательную область по сравнению с его равновесным значением, когда суммарный ток равен нулю, способствует восстановлению цинка ( II) до металла и протеканию суммарного катодного тока. Сдвиг потенциала электрода, который приводит к протеканию некоторого суммарного тока ( в отсутствие какого-либо градиента концентраций) называется активационным сверхпотенциалом. Если неоходимо увеличить суммарный ток для восстановления цинка ( II) до металла, потенциал катода следует сдвинуть в значительной мере в отрицательную область, иначе говоря, чем больший ток требуется, тем большим должен быть активационный сверхпотенциал. [14]
Страницы: 1 2 3
www.ngpedia.ru











