- Средняя плотность тела — определяется также, как отношение массы тела к его объёму.
- Плотность вещества — это плотность тел, состоящих из этого вещества или плотность вещества — это масса его единичного объёма.
- Пикнометр — прибор для измерения истинной плотности.
- Ареометр (денсиметр, плотномер) — измеритель плотности жидкостей.
- Бурик Качинского и бур Зайдельмана — приборы для измерения плотности почвы.
- Вибрационный плотномер — прибор для измерения плотности жидкости и газа под давлением.
- AT : химич. Природа, строение, свойства, механизм специфического взаимодействия с АГ
- IV.2. ХИМИЧЕСКОЕ СТРОЕНИЕ НУКЛЕИНОВЫХ КИСЛОТ
- Анатомическое строение зерна
- Анатомическое строение клубня
- Бизнес-процесс «построение учебного процесса»
- Билет № 20 ( 1) Состав, строение и свойства волокон льна.
- Биологические мембраны клетки их строение химический состав и функции.
- В здании лаборатории сельхозмашин по адресу ул. Киренского, 2, строение 1
- В здании материального склада по адресу ул. Стасовой, 48, строение 1
- В здании учебного корпуса по адресу ул. Киренского, 2, строение 2
- В мобильном здании здания по адресу ул. Стасовой, 48, строение 3
- Взаимосвязь инфляции и безработицы. Построение кривой Филлипса.
Температуры плавления и плотность некоторых соединений, встречающихся в стали и сплавах в виде включений. Плотность расплавленной стали
 ЗАДАЧНИК ОНЛ@ЙН ЗАДАЧНИК ОНЛ@ЙН  БИБЛИОТЕКА 1 БИБЛИОТЕКА 1  БИБЛИОТЕКА 2 БИБЛИОТЕКА 2 Плотность — есть скалярная физическая величина. Определяется, как отношение массы тела к его объёму. ϱ = m / V Имеется также понятия:Измерение плотностиДля измерения плотности используются:  ... 2 >> следующая страница ... 2 >> следующая страница | Плотность газов и паров. Плотность сухого воздуха. Плотность жидкостей. Плотность металлов и сплавов.Плотность газов и паровпри температуре 0o C и нормальном атмосферном давлении
Как видим из таблицы наибольшую плотность пара у Хлороформа. Водород имеет наименьшую плотность из газов. Плоность сухого воздухапри различной температуре t и нормальном атмосферном давлениии
Плотность жидкостей
Примечание. Значения плотностей жидкостей даны при нормальном атмосферном давлении и температуре 20oC (если не указана иная температура). Плотность металлов и сплавовпри температуре 20oC
Плотность сжиженных газов и расплавленных металлов
* Жидкий водород - наименее плотная жидкость. Плотность твердых тел
Примечание. Значения плотностей даны при температуре 20о С (если не указана иная температура). Плотность некоторых сельскохозяйственных продуктов
Плотность некоторых пластмасс
Плотность различных пород дерева
Плоность (средняя насыпная) некоторых материалов и продуктов
|
www.kilomol.ru
Свойства жидких металлов: плотность, теплопроводность, вязкость
Свойства жидких металлов
В таблице представлены теплофизические свойства жидких металлов в зависимости от температуры в диапазоне от 0 до 800°С. Даны следующие свойства: плотность металлов, теплопроводность, удельная (массовая) теплоемкость, температуропроводность, кинематическая вязкость, число Прандтля.
Свойства указаны для таких жидких металлов и сплавов, как ртуть Hg, олово Sn, висмут Bi, свинец Pb, сплав висмут-свинец Bi-Pb, литий Li, натрий Na, калий K, сплав натрий-калий Na-K. Для каждого металла и сплава также указана его температура плавления и кипения.
Плотность жидких металлов, представленных в таблице, значительно различается. Металлом с минимальной плотностью является литий (литий — самый легкий металл среди существующих) — его плотность в жидком состоянии при температуре 200°С равна 515 кг/м3. Наиболее тяжелый из рассмотренных жидких металлов — это ртуть. Плотность ртути при 0°С равна 13590 кг/м3. Следует отметить, что плотность жидких металлов уменьшается при нагревании.
Теплопроводность жидких металлов увеличивается при повышении их температуры (за исключением натрия и калия, теплопроводность которых имеет обратную зависимость). Наиболее теплопроводный жидкий металл — это натрий. Теплопроводность жидкого натрия имеет величину 60…86 Вт/(м·град). В целом, щелочные металлы (литий, натрий и калий) обладают высокой теплопроводностью по сравнению с другими жидкими металлами.
Кинематическая вязкость и число Прандтля жидких металлов уменьшаются при нагревании. Теплоемкость и температуропроводность этих металлов — растет. Однако, удельная теплоемкость таких жидких металлов, как свинец, олово, висмут и сплава свинец-висмут не зависит от температуры и является постоянной величиной.
Динамическая вязкость жидких металлов
Представлены значения динамической вязкости жидких металлов в зависимости от температуры в интервале от 300 до 1800 К. Динамическая вязкость жидких металлов дана в размерности Па·с·103. Например, по данным таблицы, вязкость лития при 500 К равна 0,00053 Па·с. Указана вязкость следующих металлов в жидком состоянии: литий, натрий, калий, рубидий, цезий, ртуть, висмут, свинец, олово, цинк, сурьма.
Следует отметить, что из рассмотренных металлов наиболее вязким в жидкой фазе является цинк — его коэффициент динамической вязкости составляет величину 0,0033 Па·с при температуре 700 К. Металлом, обладающим минимальной вязкостью при этой температуре, является щелочной металл калий с вязкостью 0,0002 Па·с.
Источники:1. Михеев М.А., Михеева И.М. Основы теплопередачи.2. Физические величины. Справочник. А.П. Бабичев, Н.А. Бабушкина, А.М. Братковский и др.; Под ред. И.С. Григорьева, Е.З. Мейлихова. — М.:Энергоатомиздат, 1991. — 1232 с.
thermalinfo.ru
Температуры плавления и плотность некоторых соединений, встречающихся в стали и сплавах в виде включений :: Неметаллические включения в стали
| Включения | Плотность | |
| Аl2O3 | 3,9 | 2020 |
| Al2S3 | 2,02 | 1100 |
| AlN | 3,26 | >2200 |
| Al2Si2O7 | 2,765 | 1551 |
| B2O3 | 1,84 | 600 |
| BN | 2,2 | 3000 (возгоняется) |
| CaO | 3,4 | 2500* |
| CaS | 2,15 | Разлагается |
| Ca3N2 | 2,23 | 1195 |
| CaSiO3 | 2,91 | 1540 |
| Ca2SiO4 | — | >2100 |
| CaAl2O4 | 3,67 | 1600 |
| Ca3Al2O6 | — | 1535* |
| Ca3Al10O18 | — | 1700 |
| CeO2 | 7,3 | >2600 |
| Ce2S3 | 5,02 | Разлагается |
| Cr2O3 | 5,2 | 2280 |
| CrS | 4,1 | 1550 |
| CrN | 5,9 | 1770 разлагается |
| FeO | 5,7 | 1371 |
| Fe3O4 | 5,15 | 1597 |
| FeS | 4,84 | 1190 |
| Fe4N | 6,57 | 672* |
| Fe2SiO4 | — | 1205 |
| FeSiO3 | 3,5 | 1550 |
| FeTiO3 | — | 1375 |
| FeCr2O4 | 4,55 | 2180 |
| MgO | 3,58 | 2800 |
| MgS | 2,8 | Разлагается |
| MgO*Al2O3 | 3,6 | 2135 |
| Mg2SiO4 | - | 1890 |
| MgSiO3 | - | 1560 |
| MnO | 5,45 | 1785 |
| Mn3O4 | 4,86 | 1560 |
| MnS | 4,02 | 1610 |
| MnSiO3 | 3,72 | 1270 |
| MoO3 | 4,5 | 795 |
| MoS2 | 4,8 | 1185 |
| NbO | 6,27 | - |
| Nb2O5 | 4,47 | 1520 |
| NbN | 8,4 | 2573* |
| NiO | 6,8 | 1960 |
| Ni3O4 | 3,41 | — |
| NiS | 5,45 | >800 |
| P2O5 | 2,39 | 570 |
| PbO аморф. | 9,3 | 885 |
| Pb3O4 | 9,1 | Разлагается 500 |
| PbS | 7,5 | 1.100 |
| PbSiO3 | 6,5 | 766 |
| Sb2O3 | 5,67 | 656 |
| Sb2S3 | 4,64 | 546 |
| SiO | 2,13 | 1700 (возгоняется) |
| SiO2 кварц | 2,65 | 1610** |
| SiO2 кристобалит | 2,32 | 1713 |
| SiO2 тридимит | 2,26 | 1470** |
| SiO2 стекло | 2,2 | 1725 |
| Si3N4 | — | 1810* |
| SiS | 1,85 | 940 (возгоняется) |
| SiS2 | - | 1090 |
| TiO | 4,93 | 1750 |
| Ti203 | 4,6 | 2130* |
| ТiO2 (рутил) | 4,26 | 1640 |
| TiN | 5,43 | 2950 |
| V2O6 | 4,87 | >2000 |
| V2O5 | 3,36 | 690 |
| VS | 4,2 | 1900* |
| VN | 5,63 | 2050 |
| WO2 | 12,11 | 1270* |
| WO3 | 7,16 | 1470 |
| WS2 | 7,5 | 1250* |
| W2N | - | 2750* |
| ZrO2 | 5,49 | 2700 |
| ZrN | - | 2950 |
| ZrSiO4 | 4,4 | 2430 |
| Стекло зеркальное | 2,5 | 500*** |
| Стекло обыкновенное | 2,5 | 500—600*** |
| Шамот | 1, 85—2,20 | — 1700*** |
Источник:1. М.И. Виноград. Включения в стали и ее свойства. Металлургиздат 1963 г.2. Кислинг р., Ланге Н. Неметаллические включения в стали. Металлургия 1968 г.
markmet.ru
СТРОЕНИЕ И СВОЙСТВА ЖИДКОЙ СТАЛИ.
⇐ ПредыдущаяСтр 16 из 34Следующая ⇒ПРОЦЕССЫ КРИСТАЛЛИЗАЦИИ И ФОРМИРОВАНИЯ
СТРУКТУРЫ ОТЛИВОК

СТРУКТУРА РАСПЛАВОВ СТАЛИ
Главная задача при выплавке стали получение жидкого сплава заданного химического состава, определенных физико-химических и литейных свойств с минимальными энергозатратами, расходом шихтовых материалов и продолжительностью плавки.
Жидкое состояние является промежуточным между газообразным и твердым, но ближе к твердому, особенно вблизи температуры кристаллизации. При переходе из жидкого состояния в твердое или наоборот такие свойства, как плотность, теплоемкость, объем, мало меняются. Например, увеличение объема большинства сталей при плавлении не превышает 7 %, а уменьшение плотности 5 %. Тем не менее строение жидких сплавов изучено в значительно меньшей степени, а теория жидкого состояния еще отстает в своем развитии от теорий газов и твердых тел (кристаллов). Исследования Я. И. Френкеля, В. И. Данилова, Н. Н. Боголюбова, В. М. Лившица, Л. д. Ландау, Б. А. Баума и других в определенной степени позволяют описать строение и свойства жидкости, в частности жидкого металла.
Согласно их работам, модель жидкости представляет собой среду, в которой непрерывно возникают и разрушаются микрогруппировки с упорядоченной структурой. По своему строению такие микрогруппировки близки или соответствуют твердому телу и называются по-разному: кластеры, сиботаксисы, флуктуации. для каждой температуры существует некоторое динамическое равновесие, которое позволяет установить среднестатистический размер микрогруппировок. Обычно это величины субмикроскопического порядка. С повышением температуры количество и размеры кластеров уменьшаются, а объем неупорядоченной жидкости возрастает. Время существования каждого кластера очень мало. Оно определяется интенсивностью теплового движения атомов и прочностью межатомной связи. В металлических расплавах возможно одновременное существование нескольких типов кластеров, соответствующих структуре фаз твердого металла. Например, в жидком железе при температурах около 1600 °С обнаружены микрообласти с ближним по рядком и структурой, подобной ГЦК и ОЦК.
Согласно данным Б. А. Баума, в стадии приготовления стального расплава, даже после расплавления всех компонентов и возникновения однофазной макроскопически
однородной жидкости, в ней продолжает осуществляться переход от различных типов ближнего порядка: компонентов шихты к иной, более однородной атомной структуре. Это сопровождается изменением межчастичнтх взаимодействий и атомной сегрегации. Изменение внешних условий, например температуры, приводит к изменению структуры ближнего порядка: межатомных расстояний, координационных чисел, геометрии расположения атомов и размеров кластеров. Причем эти характеристики состояния системы на атомном уровне могут изменяться значительно медленнее, чем внешние условия. Поэтому нестабильное состояние стального расплава может оказаться довольно устойчивым.
В практике известны примеры медленного макроскопического выравнивания химического состава расплавов при их легировании в плавильных печах. даже через 20 мин после введения в жидкую ванну феррохрома содержание хрома в месте отбора пробы может существенно отличаться от среднего значения. Выравнивание же состава микрообъемов требует еще большего времени. Особенно это касается расплавов легированных и высоколегированных сталей. Кроме того, реальные стальные расплавы содержат определенное количество примесей и не металлических включений, а многообразие композиций состава обеспечивает широкую гамму физико-механических свойств жидкой, твердой стали и, в целом, отливок.
При изучении механизма и кинетики процессов выплавки стали особый интерес представляет форма существования отдельных элементов в жидком расплаве. Это связано с тем, что свойства расплава, скорость переноса в нем компонентов к месту реакции, скорость самой реакции зависят от того, в какой форме компоненты находятся в расплаве.
Элементы (С, О, S, Р), у которых электроотрицательность значительно нише, чем у железа, в расплавах образуют с ним ионную и ковалентную связи, причем последняя осуществляется в результате образования квазимолекул соответствующих оксидов, фосфидов, сульфидов.
Из элементов, образующих растворы с жидким железом, особый интерес представляет углерод, который содержится во всех сталях.
В расплавах железа углерод, по-видимому, находится преимущественно в виде катионов С4+. Это подтверждается перемещением иона углерода, имеющего меньший радиус и больший заряд, чем ион железа, в сторону катода под действием постоянного электрического поля. Вероятно, углерод присутствует и в форме квазимолекул Fe3C Но группировки Fe3C неустойчивы. Это связано с тем, что каждый атом углерода может быть равновероятно связан с любыми из ближайших соседних атомов железа, которые непрерывно меняются. Происходит постоянный обмен атомами группировок Fe3C с окружающим раствором. Число ближайших к атому углерода атомов железа (координационное число) в расплаве можно оценить с учетом типа образующегося раствора и представлений о сохранении ближнего порядка в расположении атомов при плавлении.
Атомы углерода располагаются в центрах или середине граней элементарных кубических ячеек, внедряясь в октаэдрические или тетраэдрические поры между атомами железа.
Твердые растворы внедрения образуются при соотношении радиусов атомов растворенного элемента и растворителя не более 0,59 (правило Хэгга). Отношение радиусов атомов углерода (rc = 0,0824 нм) и железа (rαFe = 0,126 нм) равно 0,65, т. е. больше. Поэтому внедрение атомов углерода сопровождается искажением кристаллической решетки с увеличением свободного объема. Это подтверждается уменьшением плотности расплавов с повышением содержания углерода. Лишь в интервале 0,08—0,12%С с повышением его содержания плотность несколько увеличивается, что, по-видимому, связано с образованием наряду с квазикристаллической структурой типа δ структуры типа у. Вследствие своего большого размера атомы углерода располагаются в самых больших порах между атомами железа. В ОЦК решетке δ-Fe образуемой при 0,2—0,5% С, самые большие поры тетраэдрические. Соответственно при содержании в стали углерода менее 0,2—0,5% каждый атом углерода окружают четыре ближайших атома железа, а при более высоком содержании — шесть атомов железа. Вследствие сохранения ближнего порядка при незначительном перегреве над температурой ликвидус такой по рядок в расположении атомов сохраняется.
Кислород растворяется в жидком железе, по-видимому, с образованием группировок типа молекул ЕеО. Об этом свидетельствует значительное изменение изобарно-изотермического потенциала реакции растворения:
1/2 О2(г) = [О]; ΔG = - 117200 - 2,89 t Дж/г-атом.
Это подтверждается также повышением растворимости кислорода с повышением температуры вследствие увеличения в металле дырок. Можно предположить, что кислород не образует с железом устойчивых и постоянных молекул. Более вероятно, что атом кислорода (или скорее ион О2-) временно связывается с одним атомом железа (ионом Fе а затем с другим. Существование кислорода в форме аниона подтверждается перемещением его под действием постоянного электрического поля в сторону анода.
Сера. по-видимому, также существует в жидком железе в виде аниона S2- в постоянном электрическом поле она также перемещается в сторону анода. Вместе с тем сера образует в жидком железе микрогруппировки по типу молекул FeS. Об этом свидетельствуют значительное изменение свободной энергии ее растворения (ΔG01600 = 90640 Дж/г-атом) и острый максимум на диаграмме состояния, соответствующий составу по 50% атомов железа и серы.
Однако можно предположить, что квазимолекула FеS нестабильна во времени и в ней происходит периодическая замена одних ионов железа другими.
Фосфор образует в жидком железе преимущественно упорядоченные группировки квазимолекул Fе2P. Об этом можно судить по большому изменению свободной энергии растворения фосфора (ΔG01600 = 158300 Дж/г-атом) и отчетливому максимуму на диаграмме состояния, соответствующему составу Fе2P.
Кремний, по-видимому, присутствует в жидком железе преимущественно в ковалентном состоянии и образует микрогруппировки, подобные молекулам FeSi. Это подтверждают существенное изменение свободной энергии растворения кремния в жидком железе (ΔG01600 = 167080 Дж/г-атом) и острый максимум на диаграмме состояния Fе—Si, соответствующий соединению FеSi.
При растворении в жидком железе металлических примесей (Ni, Mn, Сг, Мо, V, Тi и др.) часть электронов их внешних оболочек коллективизируется и образуется металлическая связь. В частности, атом никеля, попадая в расплав железа, отдает валентные электроны в зону проводи- мости энергетического спектра железа и приобретает определенный за ряд, который может быть отличным от заряда железа. Происходит перекрытие d-орбиталей атомов никеля и железа, и между атомами никеля и железа появляется дополнительная связь. При этом в расплаве образуются достаточно устойчивые железоникелевые микрогруппировки, и расплав становится микронеоднородным. Перекрытие d-орбиталей приводит к образованию δ-подобной структуры ближнего порядка. В связи с более высокой энергией связи разноименных атомов по сравнению с одноименными (?Ni-Ni < ?Fe-Ni > ?Fe-Fe) добавка никеля в расплав стали приводит к значительному уменьшению межатомных расстояний и к повышению плотности расплавов. Никель широко используют для легирования сталей. Его часто вводят в шихту в процессе завалки в печь, и он начинает оказывать влияние на строение и свойства жидкой стали уже с момента расплавления.
Растворение легирующих элементов и примесей в жидком железе вызывает изменение его свойств, что влияет на процесс выплавки стали. Наиболее полно изучено влияние отдельных элементов на вязкость, плотность, поверхностное натяжение расплавов на основе железа (рис. 3.1, 3.2).
Рассмотрим влияние углерода, как правило, присутствующего во всех сталях, на основные структурно-чувствительные свойства расплавов железа (см. рис. 3.1).
Для всех исследованных физических характеристик обнаружена не монотонная зависимость с минимумом при содержании углерода в пре делах 0,15—0,20% и максимумом при 0,30—0,40% С.
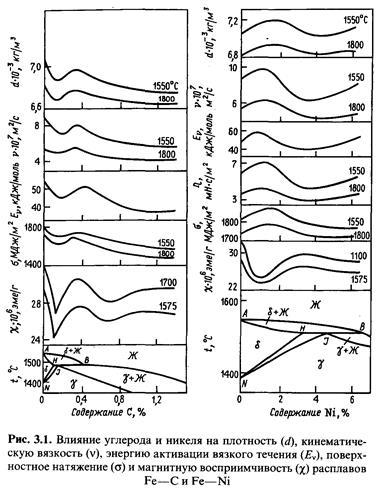
Появление максимума на кривых обусловлено образованием микрогруппировок с плотной упаковкой. Кроме того, с увеличением концентрации углерода возрастает количество микрогруппировок FexC, которые, начиная с содержания углерода 0,15—0,20%, взаимодействуют не только с окружающими их атомами железа, но и друг с другом. При этом происходит свое образное перекрытие микрогруппировок. Атом железа, входящий в микрогруппировку FexC, иными словами, связанный с одним атомом углерода, в результате «перекрытия» микрогруппировок оказывается связанным уже с двумя и более атомами углерода.
Это приводит к повышению кинематической вязкости, энергии активации вязкого течения и поверхностного натяжения. Процесс перестройки структуры ближнего порядка из δ-подобной в γ-подобную заканчивается, по-видимому, при концентрации углерода 0,3—0,5 %..
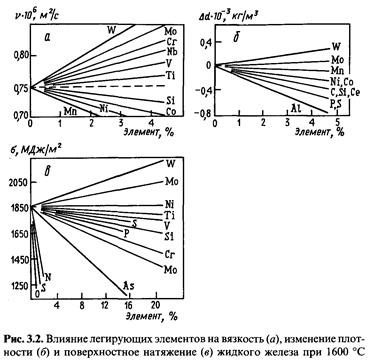
Легирование железа в зависимости от физико-химических свойств вводимого элемента сопровождается образованием в расплаве тех или иных микрогруппировок с различным периодом их устойчивости. Это отражается на вязкости жидкого железа (рис. 3.2, а). Наиболее сильно повышают кинематическую вязкость железа вольфрам, молибден, хром, ниобий, слабее — ванадий и титан, понижают марганец, никель, кобальт, кремний.
Характер структурных или химических микрогруппировок в расплавах железа существенным образом влияет и на их плотность (рис. 3.2, б). Повышают плотность жидкого железа вольфрам и молибден. Марганец, никель, кобальт незначительно ее понижают. Более существенно снижают плотность жидкого железа углерод, кремний, сера, фосфор, алюминий.
Для процессов выплавки сталей представляет интерес влияние легирующих элементов и примесей на поверхностную энергию жидкого металла, так как при значительной поверхностной активности вследствие адсорбции концентрация (сгущение) их у межфазной поверхности может существенно превышать среднюю концентрацию в объеме. Такая концентрация у поверхности влияет на степень и интенсивность развития отдельных процессов. Поверхностное натяжение жидкого железа при 1550—1600 ОС равно 1800—1850 МДж/м2. 155
Растворение в железе других компонентов снижает поверхностное натяжение (рис. 3.2, в). Наиболее сильными поверхностно-активными элементами в стали являются кислород, сера, азот, которые существенно снижают поверхностное натяжение железа, меньше его снижают мышьяк, молибден, хром. Слабой поверхностной активностью в жидком железе характеризуются фосфор, кремний, углерод, ванадий, титан. Чтобы заметно понизить поверхностное натяжение жидкого железа, их количество в расплаве должно быть довольно высоким. Практически не влияет на а железа никель, а молибден и вольфрам незначительно его повышают.
Вязкость является важной характеристикой для изучения строения металлических расплавов. Определение абсолютных значений вязкости жидких сталей также важно и для проведения гидродинамических расчетов при оценке конвективных потоков в металлической ванне, в затвердевающей отливке, при течении расплава по каналам литниковой системы, при выборе ее формы.
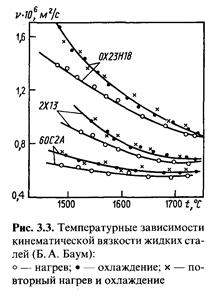 В результате многочисленных исследований кинематической вязкости различных жидких сталей было установлено явление гистерезиса вязкости. Оказалось, что вязкость сталей при первоначальном их нагреве ниже, чем при последующем охлаждении (рис. 3.3). Причем последующие циклы нагрева и охлаждения расплавов сталей не приводили к дальнейшему изменению температурной зависимости вязкости.
В результате многочисленных исследований кинематической вязкости различных жидких сталей было установлено явление гистерезиса вязкости. Оказалось, что вязкость сталей при первоначальном их нагреве ниже, чем при последующем охлаждении (рис. 3.3). Причем последующие циклы нагрева и охлаждения расплавов сталей не приводили к дальнейшему изменению температурной зависимости вязкости.
Поскольку результаты повторных измерений достаточно хорошо согласуются с данными, полученными после первого перегрева стали до предельной температуры, то можно полагать, что гистерезис вязкости объясняется изменениями в структуре расплава. При нагреве расплавов ста лей происходит уменьшение размеров и количества кластеров, в которых энергия межчастичного взаимодействия значительно превышает таковую в разупорядоченной зоне. При дальнейших циклах охлаждения и нагрева уже не образуются аналогичные микрогруппировки, которые имелись при первоначальном расплавлении и нагреве стали. Вместе с тем следует отметить, что на наблюдаемый в расплавах сталей гистерезис оказывают влияние и присутствующие в них примеси, затушевывая непосредственную связь между этим явлением и строением расплава.
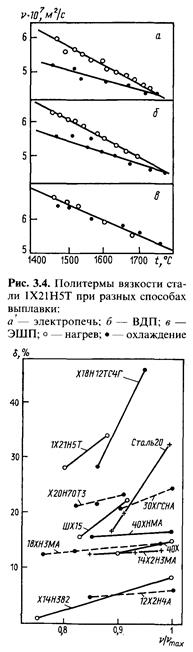 Термическая предыстория особенно сказывается на вязкости легированных сталей. Этим обстоятельством, в частности, объясняется металлургическая наследственность сплавов. Экспериментально установлено (рис. 3.4), что сталь одного и того же химического состава с одинаковым содержанием примесей, но выплавленная разными методами, имеет различную вязкость: наименьшую из открытой дуговой электропечи, но с большим гистерезисом; более высокую после вакуумно-дугового переплава, но с меньшим гистерезисом; самую высокую вязкость, но совсем без гистерезиса после электрошлакового переплава.
Термическая предыстория особенно сказывается на вязкости легированных сталей. Этим обстоятельством, в частности, объясняется металлургическая наследственность сплавов. Экспериментально установлено (рис. 3.4), что сталь одного и того же химического состава с одинаковым содержанием примесей, но выплавленная разными методами, имеет различную вязкость: наименьшую из открытой дуговой электропечи, но с большим гистерезисом; более высокую после вакуумно-дугового переплава, но с меньшим гистерезисом; самую высокую вязкость, но совсем без гистерезиса после электрошлакового переплава.
На вязкость расплавов промышленных сталей большое влияние оказывают их химический состав, содержание газов, неметаллических включений. Поэтому рафинирование сталей сопровождается снижением их вязкости.
Опыты показали, что образцы стали, отобранные для определения их вяз кости из разных зон слитка, различаются по величине вязкости. Это говорит о ее существенном изменении в процессе кристаллизации стали. Жидкая сталь зоны столбчатых кристаллов характеризуется небольшими значениями вязкости по сравнению с центральной и наружной зонами.
Существование связи между свойствами жидких сплавов и их механическими свойствами (а также служебными, специальными) в твердом состоянии в настоящее время не вызывает сомнений. Характерна эта связь и для сталей. На рис. 3.5 приведены зависимости, связывающие относительное удлинение твердого образца с вязкостью в жидком состоянии.

Образцы, более вязкие в расплавленном состоянии, обладают более высокой пластичностью.
Анализ результатов работ, проведенных разными авторами, по испытанию При равновесной темпера туре кристаллизации ( заро дыши появиться не могут, так как О, = О и Лi 0. В переох лажденном состоянии О,. <
жидкая фаза термодинамиче ски неустойчива, совершается переход из жидкого состояния в твердое. Энергия, необходи мая для образования зароды ша с радиусом т, определяется балансом уменьшения объем ной (—ЛОм) и увеличения по верхностной (+ЛО энергий системы:механических свойств литых промышленных сталей при 20 оС показал, что максимальное повышение свойств, особенно относительного удлинения δ и сужения ψ, наблюдается в тех случаях, когда в результате высокотемпературной обработки сталей в жидком состоянии устраняется гистерезис вязкости. Если выбранные режимы обработки расплавов не полностью устраняют гистерезис вязкости, а лишь уменьшают его, то повышение механических свойств оказывается меньшим и в значительной степени зависящим от величины гистерезиса.
Наиболее вероятной причиной взаимосвязи свойств жидкой и твердой стали является неравновесность расплава перед кристаллизацией. для достижения расплавом полного равновесия требуется определенное время. Поэтому степень завершенности процессов установления равновесия к моменту кристаллизации стали может оказаться различной. Ход изменения во времени структуры расплава определяет некоторые его свойства, а в случае кристаллизации из разных состояний и свойства твердого металла.
КРИСТАЛИЗАЦИЯ ФОРМИРОВАНИЕ
СТРУКТУРЫ СТАЛЬНЫХ ОТЛИВОК
В процессе кристаллизации осуществляется формирование структуры стали в отливке и образование различных дефектов.
Различают первичную и вторичную кристаллизации. Первичная кристаллизация — образование и рост кристаллов при переходе стали из жидкого состояния в твердое. Вторичная — изменение формы и размеров кристаллов во время полиморфных превращений, протекающих в твердом состоянии при охлаждении отливки в форме.
Первичная кристаллизация стали в отливке определяется многими факторами: химическим составом стали, технологией плавки (продолжительность и температура плавки, раскисление, температура выпуска из печи в ковш и т. д.), свойствами формы (теплоаккумулирующая способность, теплоемкость, теплопроводность, плотность и т. д.) и условиями заливки.
 Кристаллизация в реальных отливках является сложным процессом, и по мере развития науки о металлах вносятся все новые уточнения в теорию этого процесса.
Кристаллизация в реальных отливках является сложным процессом, и по мере развития науки о металлах вносятся все новые уточнения в теорию этого процесса.
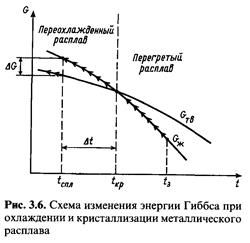
Формирование литой структуры стали начинается с образования центров кристаллизации при переохлаждении расплава на величину Δt = tкр - tспл (рис. 3.6).
При равновесной температуре кристаллизации (зародыши появиться не могут, так как Gж = Gтв и Δt = 0. В переохлажденном состоянии Gтв < Gж, жидкая фаза термодинамически неустойчива, совершается переход из жидкого состояния в твердое. Энергия, необходимая для образования зароды ша с радиусом r, определяется балансом уменьшения объемной (-ΔGV) и увеличения поверхностной (+ΔGP) энергий системы:
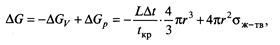 (3.1)
(3.1)
где ΔП — изменение энергии Гиббса; L - теплота кристаллизации; Δt - переохлаждение; tкр — температура кристаллизации; поверхностное натяжение на границе жидкой и твердой фаз; т радиус зародыша.
Выигрыш в энергии Гиббса при появлении новой фазы должен быть не меньше работы образования поверхности раздела. Радиус зародыша, при котором они равны, называется критическим:
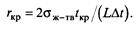 (3.2)
(3.2)
Устойчивым и способным к росту является зародыш с радиусом больше критического. Это и есть центр кристаллизации.
Из выражения (3.2) следует, что температурный интервал метастабильности фаз определяется rкр и σж-тв. Чем больше значение rкр и меньше σж-тв тем меньше интервал метастабильности.
При первичной кристаллизации стали переохлаждение жидкой фазы может меняться в широких пределах. В реальных условиях литья сталей Δt обычно не превышает нескольких десятков градусов. Однако повышение чистоты сталей в результате использования чистых синтетических шихтовых материалов, рафинирования, дезактивации нерастворимых примесей циклическими переплавами под синтетическими шлаками и т.п. приводит к увеличению Δt до нескольких сотен градусов (табл. 3.1). Таким образом, при первичной кристаллизации сталей технической чистоты переохлаждение расплава определяется содержанием в нем примесей.
Увеличение переохлаждения приводит к увеличению скорости зарождения гомогенных и гетерогенных центров кристаллизации и повышению линейной скорости роста кристаллов.

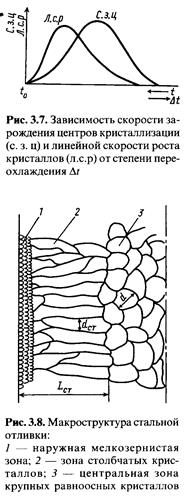 При Δt = 0 размер критического зародыша бесконечно велик, а скорость его роста равна нулю, и кристаллизация не начинается. С увеличением Δt увеличивается термодинамический стимул кристаллизации ΔG (рис. 3.7), что приводит к росту скорости зарождения кристаллов и линейной скорости роста. Приведенные выше рассуждения от носятся к гомогенному зарождению кристаллов флуктуационному образованию зародышей в случайных микрообъемах чистого расплава. В реальных расплавах всегда находятся взвешенные частицы разной природы (нитриды, оксиды и т. п.), которые очень часто служат готовыми центрами кристаллизации или подложками для их зарождения. Поэтому кристаллизация реальных расплавов начинается при более низких величинах переохлаждения и осуществляется гетерогенным механизмом на инородных твердых частицах.
При Δt = 0 размер критического зародыша бесконечно велик, а скорость его роста равна нулю, и кристаллизация не начинается. С увеличением Δt увеличивается термодинамический стимул кристаллизации ΔG (рис. 3.7), что приводит к росту скорости зарождения кристаллов и линейной скорости роста. Приведенные выше рассуждения от носятся к гомогенному зарождению кристаллов флуктуационному образованию зародышей в случайных микрообъемах чистого расплава. В реальных расплавах всегда находятся взвешенные частицы разной природы (нитриды, оксиды и т. п.), которые очень часто служат готовыми центрами кристаллизации или подложками для их зарождения. Поэтому кристаллизация реальных расплавов начинается при более низких величинах переохлаждения и осуществляется гетерогенным механизмом на инородных твердых частицах.
Структура стальной отливки характеризуется формой и размерами кристаллов, называемых обычно зернами и видимых при специальном травлении на шлифах без увеличения или при небольшом увеличении (до х20), а также элементов дендритной микроструктуры, наблюдаемых под микроскопом.
Макроструктура затвердевшей отливки имеет три зоны (рис. 3.8):
1) наружную мелкозернистую зону разориентированных. кристаллов;
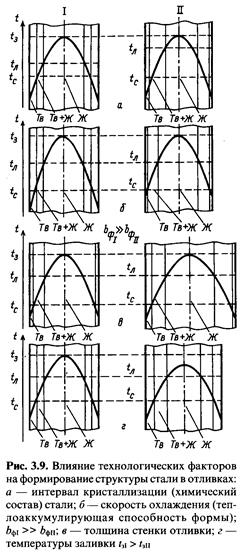 2) промежуточную зону столбчатых кристаллов, вытянутых в направлении тепло-отвода;
2) промежуточную зону столбчатых кристаллов, вытянутых в направлении тепло-отвода;
3) центральную зону равноосных кристаллов.
В начальный период кристаллизации корка, температура которой близка к температуре солидус, а также нагревшиеся стенки и зазор между коркой и формой уменьшают теплопередачу от жидкой стали и степень переохлаждения. При этом растут преимущественно кристаллы, главные оси которых ориентированыны параллельно на правлению теплоотвода. Образуется зона столбчатых кристаллов, причем сечение зерен, растущих в направлении тепло- отвода, увеличивается по мере удаления от поверхности формы вследствие блокировки и поглощения ими зерен с менее благоприятной ориентировкой.
Зона столбчатых кристаллов граничит с зоной крупных равноосных зерен в центре сечения стенки отливки. Они об разуются из жидкой фазы, когда из-за небольшого переохлаждения возникает малое количество зародышей кристаллизации и имеются в расплаве беспорядочно разбросанные готовые центры в виде твердых частиц: об ломки дендритов, неметаллические включения и др.
Величина той или иной зоны в отливках зависит в первую очередь от химического состава стали (интервала кристаллизации), скорости охлаждения отливки, материала формы, ее теплоаккумулирующей способности, температуры заливки металла в форму. Характер воздействия этих факторов можно рассмотреть с помощью схем, представленных на рис. 3.9.
• Интервал кристаллизации (рис. 3.9, а). Рассмотрим затвердевание двух одинаковых отливок, но изготовленных из сплавов с различным интервалом кристаллизации (tл - tс). Все остальные параметры (температура заливки, вид формы) в обоих случаях одинаковы.
В фиксированный момент времени после заливки изменение температуры металла описывается параболой. Температура поверхностного слоя отливки будет одинаковой, поскольку в единицу времени форма аккумулирует одно и то же количество тепла. Пересечение изотермы tc с параболой указывает, какой слой металла имеет температуру ниже, т. е. к этому моменту времени затвердеет часть отливки, температура металла которой лежит в интервале tл - tс и имеет двухфазную зону (тв + ж). В I случае протяженность зоны мелкозернистых кристаллов (тв) будет шире, чем во II случае (широкоинтервальный сплав), величина двух фазной зоны (тв + ж) будет уже, а в центральной части тела отливки отмечается более широкая зона жидкого металла.
При дальнейшем охлаждении отливок характер затвердевания сохранится. И после полного затвердевания в узкоинтервальном сплаве I зона мелкозернистых кристаллов 1 и столбчатых 2 (см. рис. 3.8) будет шире, а зона равноосных разноориентированных кристаллов 3 уже. И наоборот, сталь с более широким интервалом кристаллизации будет иметь в структуре отливки меньшую протяженность зоны мелкозернистых и большую протяженность зоны толстых разветвленных дендритов 2 и зоны равноосных кристаллов 3.
Скорость охлаждения. Отливки из одной и той же стали с одинаковым перегревом заливаются в формы, изготовленные из различных материалов (рис. 3.9, 6). В этом случае коэффициент теплоаккумулирующей способности bФI значительно выше, чем в случае II (bФI >> bФII). В фиксированный момент времени поверхностный слой отливки в I случае будет охлажден до более низких температур и зона мелкозернистых кристаллов будет шире. Зона твердо-жидкого металла будет уже, что способствует росту узких дендритов в направлении теплоотвода. В случае II в отливке формируются узкая зона мелкозернистых кристаллов, широкая зона крупных разветвленных дендритов и более широкая зона равноосных кристаллов.
Толщина стенки отливки (рис. 3.9, в). Одна и та же сталь при одной и той же температуре заливается в одинаковые формы (bФI = bФII).
При увеличении толщины стенки отливки уменьшается протяженность зоны мелкозернистых кристаллов I (см. рис. 3.8), увеличивается протяженность зоны жидкой фазы и, следовательно, зоны крупных равноосных кристаллов 3, уменьшается ширина зоны дендритных кристаллов 2, так как широкая двухфазная зона будет способствовать росту толстых дендритов, что создает благоприятные условия для роста фазы во всех трех направлениях.
• Перегрев металла (температура заливки) (рис. 3.9, г). Одна и та же сталь заливается в одинаковые формы, но в случае I температура заливки выше, чем в случае II (tзалI > tзалII. В результате аналогичных рассуждений можно констатировать, что высокая температура заливки уменьшает ширину твердой, твердо-жидкой фаз и увеличивает ширину жидкой фазы. Это приводит к тому, что зоны мелкозернистых 1 и крупных равноосных кристаллов 3 (рис. 3.8) уменьшаются, а зона узких дендритных, столбчатых кристаллов значительно увеличивается, поскольку создаются благоприятные условия для их роста.
Таким образом, малый интервал кристаллизации стали, повышенная скорость охлаждения отливки, увеличение перегрева металла, его низкая теплопроводность приводят к формированию преимущественно столбчатой, дендритной структуры, а снижение температуры заливки и скорости охлаждения отливок, высокая теплопроводность, большая толщина стенки отливки — к формированию преимущественно разноориентированной крупнозернистой структуры. Качество литой стали и отливок из нее повышается при измельчении структуры и сокращении протяженности зоны столбчатых кристаллов. Поэтому процессы выплавки сталей и условий их затвердевания в отливках регулируют таким образом, чтобы обеспечить образование мелкозернистой равноосной структуры: а именно, выбором оптимальной температуры заливки, использованием внепечных методов обработки расплавов, модифицированием, дифференцированным охлаждением различных частей отливок и др.
ЛИКВАЦИЯ СТАЛИ В ОТЛИВКАХ
Ликвацией называют химическую неоднородность металла отливки, возникающую при ее затвердевании.
Различают зональную и дендритную ликвацию. Зональная ликвация это химическая неоднородность в пределах всей отливки в целом, дендритная в пределах одного дендрита. Часто дендритную ликвацию называют внутрикристаллитной.
Причина ликвации изменение растворимости компонентов стали в процессе кристаллизации. Склонность элемента к ликвации тем сильнее, чем больше разница в его растворимости в жидкой и твердой стали.
Степень ликвации зависит от соотношения скорости кристаллизации матрицы и скорости диффузии ликвирующего элемента. Элементы, образующие с железом твердые растворы внедрения (С, N, Н, В и др.) и обладающие достаточно высокими коэффициентами диффузии, более склонны к ликвации, чем элементы, образующие растворы замещения (Сr, V, Ni, Mn и др.).
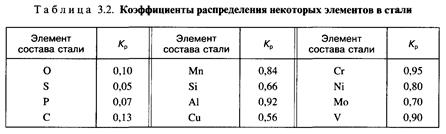
Оценить склонность компонентов стали к ликвации можно с помощью коэффициента их распределения (Кp) между твердой и жидкой фазами в процессе первичной кристаллизации.
Коэффициент распределения представляет собой частное от деления предельной растворимости элемента в твердой стали к его предельной растворимости в жидкой фазе:
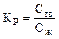 .
.
Чем больше различие в растворимости компонентов в жидкой и твердой фазах стали, чем больше отличаются они по температурам плавления, чем выше их коэффициент диффузии и чем больше сродство к образованию стойких химических соединений, тем больше их склонность к ликвации.
По уменьшению склонности к ликвации элементы могут быть расположены в следующий ряд: S, Р, В, С, W, Аs, V, Тi, Мо, Сu, Аl, Сr, Mn, Со, Ni.
Значения коэффициентов К рассчитанные по соответствующим двойным диаграммам состояния железо - элемент, приведены в табл. 3.2.
Коэффициенты диффузии некоторых элементов в стали при различных температурах приведены в табл. 3.3.
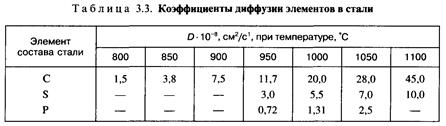
Зональная ликвация серы, фосфора и углерода или химическая неоднородность в отливках усиливаются в условиях медленного охлаждения, т. е. в массивных частях отливок. Наблюдаются две разновидности химической неоднородности: осевая V-образная (прямая ликвация) и внеосевая  -обраэная (обратная ликвация) (рис. 3.10). Второй вид неоднородности обычно еще называют «усы». Схема образования зональной ликвации приведена на рис. 3.11.
-обраэная (обратная ликвация) (рис. 3.10). Второй вид неоднородности обычно еще называют «усы». Схема образования зональной ликвации приведена на рис. 3.11.
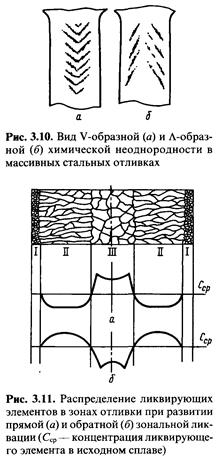 Осевая неоднородность образуется вследствие усадочных перемещений жидкости, обогащенной примесями в осевой части стенки отливки. Такое перемещение происходит в условиях затрудненного питания осевой двухфазной зоны, когда отдельные кристаллиты, растущие навстречу друг другу, смыкаются и под ними начинает образовываться усадочная полость. В усадочную полость засасывается ликват, обладающий пониженной температурой плавления. для уменьшения и предотвращения такой неоднородности следует ускорить охлаждение отливки, способствующее уменьшению ширины двухфазной зоны (см. рис. 3.9), и усилить степень направленности затвердевания.
Осевая неоднородность образуется вследствие усадочных перемещений жидкости, обогащенной примесями в осевой части стенки отливки. Такое перемещение происходит в условиях затрудненного питания осевой двухфазной зоны, когда отдельные кристаллиты, растущие навстречу друг другу, смыкаются и под ними начинает образовываться усадочная полость. В усадочную полость засасывается ликват, обладающий пониженной температурой плавления. для уменьшения и предотвращения такой неоднородности следует ускорить охлаждение отливки, способствующее уменьшению ширины двухфазной зоны (см. рис. 3.9), и усилить степень направленности затвердевания.
Внеосевая неоднородность образуется между первой поверхностной и осевой зонами кристаллизации. Она формируется также в двухфазной зоне затвердевания, перемещающейся к центру стенки. И хотя на этой стадии в централь ной части сечения стенки есть еще свободный жидкий металл, питание затвердевающего металла затруднено двухфазной зоной. В этой зоне образуются отдельные изолированные объемы жидкого металла, в которых возникают усадочные пустоты, куда стекает из вышерасположенных объемов обогащенная примесями жидкость. Особенность расположения внеосевой неоднородности объясняется наличием торцевого эффекта охлаждения снизу. В этих условиях в нижней части отливки раньше всего образуется двухфазная зона, что обусловливает локализацию ликватов вблизи боковой поверхности отливки. По мере перемещения двухфазной зоны от поверхности к осевой зоне и всплывания ликватов зона образования ликвационных шнуров также перемещается вверх, приближаясь к осевой части отливки.
В качестве мер борьбы с внеосевой химической неоднородностью могут быть использованы: ускорение охлаждения с помощью наружных и внутренних холодильников, понижение температуры заливки и активация перемешивания металла в процессе заполнения формы.
Наиболее радикальным средством предотвращения зональной ликвации обоих видов является снижение содержания в стали ликвирующих элементов: серы, фосфора, углерода. Так, рекомендуется для этих целей обеспечивать содержание серы и фосфора в стали по 0,01—0,015% каждого. При этом, однако, следует учитывать зависимость склонности этих элементов к ликвации от содержания в стали углерода. На основе экспериментальных данных установлено, что коэффициенты диффузии серы и фосфора уменьшаются с увеличением содержания в стали углерода, и наоборот коэффициент диффузии углерода уменьшается при увеличении содержания серы.
При низком значении коэффициента диффузии затрудняется выравнивание состава металла в процессе охлаждения отливки в форме. Даже при самом медленном охлаждении отливки не происходит сколько-нибудь значительного уменьшения степени ликвации серы и фосфора. По этой причине не дает положительного эффекта и диффузионный отжиг отливок.
В отливках из углеродистой стали, где содержание примесей соответствует ГОСТу, о степени развития ликвации можно судить по толщине стенки отливки. Так, в отливках с толщинами стенок до б0—80 мм ликвация серы, фосфора и углерода не достигает опасных значений (табл. 3.4). Меры по предотвращению ликвации необходимо предпринимать только для отливок с толщиной стенки более 80 мм.
В отличие от макроскопической зональной ликвации микроскопическая внутрикристаллитная, или дендритная ликвация стали оказывает большое влияние на качество отливок, т. е. на некоторые специальные и более чувствительные к тонкому строению стали свойства, как, например, жаропрочность, коррозионная стойкость, и др. Эксперимент и практика показывают: чем выше концентрация элемента в стали, тем в большей степени развивается его ликвация.
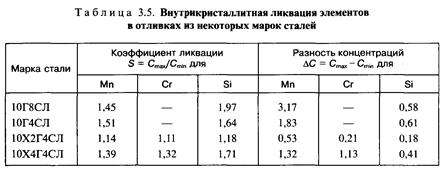
Ликвация каждого элемента изменяется в зависимости от конкретного состава стали, от состава легирующего комплекса, что иллюстрируется данными, полученными по результатам микроренгеноспектрального анализа (табл. 3.5).
Читайте также:
lektsia.com
Плотность - расплав - Большая Энциклопедия Нефти и Газа, статья, страница 1
Плотность - расплав
Cтраница 1
Плотности расплава и твердого вещества обычно различны. [2]
Плотность расплава полиэтилентерефталата при 280 С равна 1 2 г / см3, вязкость его при молекулярном весе полимера около 20 000 составляет 2000 - 2500 пуазов. [3]
Плотность применяемых расплавов при 700 находится в пределах от 1 55 до 1 60 г / см3, повышаясь с увеличением содержания хлористого магния. [4]
Плотность расплава солей ( 1926 кг / м3) значительно превышает плотность резиновых смесей, и поэтому заготовка довольно сильно прижимается к стальной ленте погружного транспортера. Это может вызвать искажение профиля изделия; в некоторых случаях вулканизация в расплаве солей становится практически невозможной. [5]
Плотность расплавов системы Fe - А1 изучали в работах [55, 96], но эти измерения не охватывают всю область концентраций. [6]
Изменение плотности расплава в трубах типа А2 носит своеобразный характер. При применении таких активаторов, которые при 100 не растворяются в расплаве лактама, даже при более высокой температуре предварительной полимеризации различия в плотности расплава предполимеризата и расплава в трубе НП незначительны. Поэтому проскок подаваемого в верхнюю часть трубы НП расплава предполимеризата происходит в той же степени, как и при непосредственной подаче ( без предварительной полимеризации) расплава лактама при температуре 100 независимо от того, содержит ли этот расплав активаторы или нет. Благодаря такому конструктивному решению значительно увеличивается производительность системы; так, производительность трубы типа А2 примерно на 30 % больше, чем трубы типа А1 при равном объеме труб. [7]
Увеличение плотности расплава связано с изменением структуры ближнего порядка в направлении более плотной упаковки. На примере антимонида индия экспериментально доказано, что для расплава координационное число равно 6, в то время как для самой кристаллической решетки координационное число равно лишь 4, что соответствует рыхлой упаковке атомов. [9]
Изменение плотности расплавов значительно зависит от концентрации составляющих компонентов. У бинарных расплавов плотность изменяется линейно в зависимости от состава, если энергии взаимодействия компонентов ( Me - x) примерно одинаковы или близки друг к другу. В этом случае расплав приближается к идеальным растворам и изменение плотности в зависимости от концентрации подчиняется закону аддитивности. [11]
Снижение плотности расплава происходит по мере увеличения в системе концентрации глинозема. [13]
Измерение плотности расплавов системы Fe - Cull, 90 ] показывает, что при смешении жидких железа и меди наблюдается декомпрессия. Авторы [106] на основании полученных сведений о концентрационной зависимости р расплавов Fe-Си делают вывод, что свойства расплавов этой системы имеют положительные отклонения от поведения идеальных растворов. [14]
Измерения плотности расплавов галогенидов щелочных металлов, выполненные Яффе и Ван-Артсдаленом [29], необходимо рассматривать как наиболее надежные. [15]
Страницы: 1 2 3 4 5
www.ngpedia.ru
расплавленных плотность - Справочник химика 21
Метод физико-химического анализа заключается в следующем. Измеряют какое-нибудь физическое свойство раствора или расплава (плотность, вязкость, температуру плавления, давление пара, поверхностное натяжение, электропроводность, показатель преломления, диэлектрическую проницаемость и т. д.). Последовательно изменяя состав, получают таблицу числовых данных измеряемого свойства. С помощью этих данных строят диаграмму состав — свойство. Изучают геометрические особенности диаграмм состав — свойство для растворов различных компонентов и ищут зависимость между геометрическими особенностями такой диаграммы и природой раствора. [c.167] Сказанное справедливо для любых полимерных образцов независимо от их происхождения — полученных сополимеризацией двух или более мономеров либо по реакции химического превращения звеньев в сформированных ранее макромолекулах. Так, растворимость, вязкость расплавов, плотность, разрывная прочность блок-сополимеров этилена и пропилена зависят от длины однород- [c.8]В расплаве форма макромолекул отклоняется от статистического клубка вследствие тенденции соседних сегментов цепи (или сегментов соседних цепей) укладываться более или менее параллельно но отношению друг к другу. Однако уменьшение плотности на 20%, происходящее при повышении температуры линейного ноли-этилена от комнатной температуры расплава (плотность ири этом снижается от 0,98 до 0,78 г см ), свидетель- [c.135]
Физические свойства расплава (плотность, вязкость, поверхностное натяжение) оказывают влияние на гидродинамику процесса, на скорость и степень хлорирования. С увеличением поверхностного натяжения расплавленной соли скорость хлорирования уменьшается. Вязкость расплава не во всех случаях оказывает аналогичное влияние. Это относится к хлориду магния, обладающему относительно высокой вязкостью. По-видимому, преобладающее значение имеет повышенная растворимость в хлориде магния реакционных газов и лучшая смачиваемость в его среде оксидов и кокса. [c.15]
Индекс расплава. ... Плотность, г/слеЗ. . . Температура замерзания кристаллитов, °С [c.92]
При плавлении кристаллических пентафторидов образуются умеренно вязкие расплавы. Плотности и вязкости их в точках плавления приведены ниже [14] [c.70]
Экструдеры можно применять для переработки термопластических полимерных материалов с различными физическими свойствами (вязкость расплава, плотность и др.). Машины комплектуются набором взаимозаменяемых шнеков. Температура в цилиндре экструдера регулируется автоматически. По мере продвижения массы от бункера к головке экструдера температура ее повышается. Для этого служат электронагревательные элементы, надетые на цилиндр. Для охлаждения применяют обдувку воздухом, который подается на цилиндр специальными вентиляторами. [c.119]
Результирующая линия представляет собой типичную кривую, характерную для полиэтиленов всех марок. В зависимости от конкретных свойств расплава, плотности и хода кристаллизации несколько изменяется точное положение кривой и величина минимума для разных марок полиэтилена. [c.260]
Характеристики шприцмашины. Если пренебречь утечкой, то зависимость между производительностью шприцмашины и давлением в головке для общего случая, в котором вязкость расплава, плотность расплава и размеры канала изменяются вдоль оси червяка, описывается интегральной формой уравнения (66) [c.227]
Хотя в большинстве практически важных случаев кристалличность или плотность полиэтилена вполне определяется относительным содержанием боковых ответвлений, это справедливо только для равновесных условий. В некоторых случаях равновесная степень кристалличности может и не достигаться, и тогда это обстоятельство необходимо принимать во внимание. Если расплав полиэтилена обычного молекулярного веса очень резко охладить (закалить), то степень кристалличности оказывается меньше, чем равновесная кристалличность, достигаемая при медленном охлалрасплава Плотность полиэтилена высокого давления легко изменять в пределах от 0,915 до 0,920 г см , варьируя скорость охлаждения из расплава. Плотность линейного полиэтилена в еще большей степени зависит от скорости охлаждения, поскольку равновесная степень кристалличности этого полимера выше. Образцы, равновесная плотность которых составляет 0,960 легко закалить так, чтобы их плотность уменьшилась [c.246]
Третьи задачи связаны с анализом самого полимерного материала. Можно утверждать, что это практически всегда самая сложная часть работы. И здесь для анализа стандартного продукта при его промышленном синтезе используется минимальное число методик определение вязкости, показателя текучести расплава, плотности и др. Но для оптимизации свойств материала в ходе разработки технологического процесса потребуется разработка методов анализа молекулярных масс, ММР, состава, распределения звеньев в случае сополимера, композиционной неоднородности, технологических свойств и т. п. [c.149]
При электролитическом лужении из солевых расплавов плотность тока можно изменять в довольно широких пределах — от 50 до 1000 Ыдм . Это позволяет значительно сократить время лужения по сравнению с тем, которое требуется при лужении из водных электролитов. Жесть, полученная при электролитическом лужении из солевых расплавов, по коррозионной стойкости не уступает жести горячего лужения [151. [c.126]
Физико-химический анализ заключается в следующем. Измеряют какое-нибудь физическое свойство раствора или расплава (плотность, вязкость, температуру плавления, давление пара, поверхностное натяжение, электропроводность, показатель преломления, диэлектрическую проницаемость и т. д.). Последовательно изменяя состав, получают таблицу числовых данных измеряемого свойства. Исходя из этих [c.70]
В основу классификации полиэтилена положены следующие характеристики метод производства (низкое и высокое давление), метод усреднения полиэтилена (холодное смешение или в расплаве), плотность полиэтилена и индекс расплава. [c.59]
Температура литья определяет текучесть расплава, плотность, степень ориентации макромолекул полимера прн течении в фор.ме. [c.202]
В результате деаэрации — удаления попавшего при изготовлении смазки воздуха — улучшается внешний вид, повышается химическая стабильность и плотность смазок [5]. При получении смазок на сухих мылах во время дозирования сухого мыла в нее попадает много воздуха, который удаляется из расплава при повышенных температурах. При получении мыла в процессе производства смазки часть воздуха уходит вместе с парами воды, а оставшуюся часть удаляют на заключительной стадии [c.98]
Продолжительность испытания 5 ч, после чего установку выключают, образцы сталей после остывания извлекают из обоймы и подвергают электрохимическому травлению в расплаве 40% карбоната натрия и 60% гидроксида натрия при температуре 480 и плотности тока 16 А/дм . Время травления образцов сплава до полного удаления с их поверхности продуктов коррозии составляет 6-8 мин и устанавливается визуально-по появлению характерного металлического блеска на всей поверхности образца. После травления образцы промывают, сушат и помещают на 1 ч в эксикатор, затем взвешивают с точностью +0,0002 г. Скорость коррозии [X, гДм ч)] рассчитывают по формуле [c.180]
Толщина пленки расплава над пробкой материала при плотности р = 795 кг/м , соответствующей средней температуре пленки СР = 197 °С, согласно (12.47) будет [c.359]
Если рассматривать промежутки между крупными ветвями фрактальных ядер дисперсной фазы в качестве капилляров, то под воздействием высокочастотного УЗ-поля расклинивающее давление капиллярного эффекта может привести к частичному разрушению кластеров и их последующей уплотнительной реструктуризации. Цель этого процесса - увеличение фрактальной размерности ядер и плотности частиц дисперсной фазы на высших масштабных уровнях. Открытый эффект уже широко используется в промышленности, например, как способ пропитки капиллярных пористых тел жидкостями и расплавами, в частности, полимерным связующим [28]. [c.26]
Плотность гомополимера полиэтилена Филлипс варьируется от 0,965 для низкомолекулярного полимера с высоким индексом расплава до 0,960 для полимеров с индексом расплава 0,3—0,5. Полимеры сверхвысокой молекулярной массы обладают более низкой плотностью 0,94. Уменьшение плотности с ростом молекулярной массы обусловлено переплетениями цепей. Очень длинные молекулы переплетаются настолько, что затрудняют полную кристаллизацию. Полимеры с широким молекулярно-массовым распределением (ММР) имеют несколько более высокую плотность, чем полимеры с узким ММР, так как короткие молекулы могут ориентироваться относительно сегментов длинных молекул, облегчая кристаллизацию. [c.172]
На скорость и степень хлорирования в расплаве влияют следующие факторы температура, скорость подачи хлора, высота слоя расплава, плотность, вязкость и йоверхностное натяжение расплава, свойства и степень помола восстановителя, способ загрузки шихты в реактор и характер распределения твердых частиц в объеме расплава. [c.547]Выявленная взаимосвязь параметров растворения алмазосодержащих спеков с аддитивным свойством расплава (плотностью) может служить контролирующим показателем в случае отклонения режима сплавления от заданных параметров не-ттравильной загрузки реагентов и т. д. Наряду с общей характеристикой, свидетельствующей о растворении металлов в плаве, важным показателем этого процесса явля- [c.464]
Известно, что интенсивность свободно конвекции в расплаве определяется температурными условиями кристаллизации. В расплавах, плотность которых уменьшается с увеличением температуры, конвект1шные потоки не возникают до тех пор, пока произведение кретериев Грасгофа и Прандля мало [61]. Если это произведение достигает значения 1700, то возникают потоки свободной конвекции. Такое состояние поддерживается до тех пор, пока величина указанного произведения не превышает значения 47000, и выше этой величины поток приобретает турбулентный характер. [c.62]
Хотя описанный выше метод Штёбера основан на охлаждении расплава в направлении снизу вверх, очевидно, что перемена горячей и холодной зон местами приведет просто к изменению направления затвердевания. Несмотря на то что такое обратное направление температурного градиента осуществить труднее [82], оно оказывается необходимым, когда имеют дело с расплавом, плотность которого с уменьшением температуры понижается во всей области применяемых температур, так как это приводит к сильным конвекционным потокам, нарушающим горизонтальные изотермические сечения [57]. [c.231]
TlSe. Селенид таллия Т13е — мягкое слоистое веш ество черно-лилового цвета с металлическим блеском. Плавится без разложения нри 330° С при небольшом (—1 мм рт. ст.) давлении пара селена над расплавом. Плотность 8,2 г см . Соединение довольно легко можно получить сплавлением таллия и селена в стехиометрических количествах в запаянных под вакуумом ампулах, наполненных водородом или аргоном после откачки воздуха. TlSe — устойчивое на воздухе и в воде соединение, растворимое на холоду в минеральных кислотах. [c.154]
Плотность. На кривой зависимости плотности от состава в системе NaF — AlFg (рис. 228) при 25% (мол.) AlFg наблюдается максимум плотности, соответствующий образованию криолита. Избыток NaF и A1F , (против ( )ормулы криолита) снижает плотность расплава. Плотность расплава снижает и добавка глинозема к криолиту (рис. 228). aFa увеличив, ет нлот-ии-сть криолито-глиноземного расплава. [c.430]
Плотность дислокаций — важнейшая техническая характеристика качества кристалла. В кристаллах, выращенных обычными методами кристаллизации из расплава, плотность дислокаций составляет (10 —10 ) см . Путем отжига можно понизить эту плотность до (10 —10 ) см" . В результате пластической деформации плотность дислокаций быстро возрастает на несколько порядков. Наилучшие полупроводниковые кристаллы удается вырастить с плотностью дислокаций (10 —10 ) см ,в наилучших лабораторных условиях выращивают кристаллы с плотностью дислокаций порядка нескольких единиц на см и бездислокациопные кристаллы. [c.325]
Прежде всего среди этих дополиительных методов следует отметить определение плотности полимера. Сугцествуют два крайних значения плотности полимера для аморфного полимера (эта величина получается экстраполированием на необходимую температуру по кривой изменения плотности расплава полимера с температурой) и для кристаллического состояния (эта величина рассчитывается из упаковки полимерных цепей в элементарной кристаллической ячейке, определяемой на основе данных рентгеноструктурного анализа). Определенная экспериментальным путем (например, по рав-н()] есному положению в трубке с градиентом плотности или пикно-мотричоски) плотность позволяет оценить содержание упорядочен-н()11 части в полимере или условную степень кристалличности по схеме, изображенной на рис. 10.8, где точка соответствует теоретической плотности монокристалла, а — экстраполированной по данным и з расплава плотности аморфного полимера и э — экспериментальной нлот-ности исследуемого образца. Степень кристалличности К, определенная по этому методу, не является истинной, как и рассчитанная по описанным ранее методам оценки кристалличности. Недостатки данного метода связаны как с возмо кными ошибками при определении кристаллографической ячейки и при экстраполяции плотности из области расплава на нормальные температуры, так и с тем, что плотность аморфных областей [c.240]Количество пара, выделяющегося из расплава, зависит от содержания в нем воды, от его массы, исходной температуры и давления, а также от интервала температур и давлений, при которых происходит кристаллизация. Размеры магматического тела являются существенным фактором, определяющим время остывания интрузии и тем самым время, в течение которого из кристаллизующегося расплава выделяется вода. Вследствие более облегченного разряжения внутреннего давления на поверхности земли в эффузивном процессе отделение водяного пара (и других флюидов) происходит быстрее, чем в интрузивном. Последний процесс происходит в более замкнутой системе и потому понижение температуры и давления в нем происходит более медленно и равномерно. Кристаллизация охлаждающегося интрузива замедляется выделением скрытой теплоты плавления, сопровождающим кристаллизацию и, кроме того, движением масс внутри интрузивного тела вследствие конвекции [Хитаров Н. И., 1967 Whitney J. А., 1975]. Конвекция вызывается не только температурным градиентом, но и различием в плотности расплава, содержащего разные количества воды. Чем больше воды в расплаве, тем меньше его плотность. [c.147]
Н. П. Ермаков (1950, 1978 гг.) разработал классификацию включений в минералах для определения генетических типов пород. Метод этот широко применяется у нас и за рубежом [Захарченко А. И., 1972 Берзина А. Р., Сотников В. И., 1972 и др.]. Н. П. Ермаков различал затвердевшие включения расплавов, пневматолитовые газовые включения растворов малой плотности, при нагревании гомогенизирующиеся в газовую фазу (И тип гомогенизации), и гидротермальные включения жидких растворов с пузырьком пара, при нагревании заполняющиеся жидкой фазой (I тип гомогенизации). Пользуясь этим методом, стало возможным отличать минералы пневматолитового генезиса от минералов магматического и гидротермального происхождения. [c.151]
Кривая анодной поляризации железа в расплаве Na l и начальный участок катодной кривой спрямляются в координатах 1/—Ig /, что свидетельствует о логарифмической зависимости анодной и катодной поляризации от плотности тока. [c.410]
Обезуглероживание стали в расплаве 50% Na l 50% Ba lj 1 — без защиты током 2 — с катодной защитой при плотности тока i, — I А/дм [c.412]
Плотность шлакового расплава. Знание величины плотности шлакового расплава необходимо для расчета объема оборудования, кинетики ликвационного разделения фаз и в ряде других случаев. Плотность шлаков возрастает при введении добавок с большой удельной массой (FegOj, ZnO, BaO) и снижается при добавлении более легких компонентов (СаО, MgO, SiOj и др.). С повышением температуры плотность шлаковых расплавов понижается. [c.82]
chem21.info
16.Физические и химические свойства металлов. Цвет, плотность металла, температура плавления, теплопроводность, тепловое расширение, теплоемкость, электропро-водность. Магнитные свойства.
. ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВАФизические свойства. К физическим свойствам металлов относят цвет, плотность, температуру плавления, теплопроводность, тепловое расширение, теплоемкость, электропроводность, магнитные свойства и др.Цветом называют способность металлов отражать световое излучение с определенной длиной волны. Например, медь имеет розово-красный цвет, алюминий - серебристо-белый.Плотность металла характеризуется его массой, заключенной в единице объема. По плотности все металлы делят на легкие (менее 4500 кг/м3) и тяжелые. Плотность имеет большое значение при создании различных изделий. Например, в самолето- и ракетостроении стремятся использовать более легкие металлы и сплавы (алюминиевые, магниевые, титановые), что способствует снижению массы изделий. Температурой плавления называют температуру, при которой металл переходит из твердого состояния в жидкое. По температуре плавления различают тугоплавкие металлы (вольфрам 3416°С, тантал 2950°С, титан 1725°С, и др.) и легкоплавкие (олово 232°С, свинец 327°С, цинк 419,5°С, алюминий 660°С). Температура плавления имеет большое значение при выборе металлов для изготовления литых изделий, сварных и паяных соединений, термоэлектрических приборов и других изделий. В единицах СИ температуру плавления выражают в градусах Кельвина (К).Теплопроводностью называют способность металлов передавать тепло от более нагретых к менее нагретым участкам тела. Серебро, медь, алюминии обладают большой теплопроводностью. Железо имеет теплопроводность примерно в три раза меньше, чем алюминий, и в пять раз меньше, чем медь. Теплопроводность имеет большое значение при выборе материала для деталей. Например, если металл плохо проводит тепло, то при нагреве и быстром охлаждении (термическая обработка, сварка) в нем образуются трещины. Некоторые детали машин (поршни двигателей, лопатки турбин) должны быть изготовлены из материалов с хорошей теплопроводностью. В единицах СИ теплопроводность имеет размерность Вт/(м∙К).Тепловым расширением называют способность металлов увеличиваться в размерах при нагревании и уменьшаться при охлаждении. Тепловое расширение характеризуется коэффициентом линейного расширения α=(l2-l1)/[l1(t2-t1)], где l1 и l2длины тела при температурах t1 и t2. Коэффициент объемного расширения равен 3α. Тепловые расширения должны учитываться при сварке, ковке и горячей объемной штамповке, изготовлении литейных форм, штампов, прокатных валков, калибров, выполнении точных соединений и сборке приборов, при строительстве мостовых ферм, укладке железнодорожных рельс. Теплоемкостью называют способность металла при нагревании поглощать определенное количество тепла. В единицах СИ имеет размерность Дж/К. Теплоемкость различных металлов сравнивают по величине удельной теплоемкости - количеству тепла, выраженному в больших калориях, которое требуется для повышения температуры 1 кг металла на 1°С (в единицах СИ - Дж/(кг∙К).Способность металлов проводить электрический ток оценивают двумя взаимно противоположными характеристиками -электропроводностью и электросопротивлением. Электрическая проводимость оценивается в системе СИ в сименсах (См), а удельная электропроводность - в Cм/м, аналогично электросопротивление выражают в омах (Ом), а удельное электросопротивление — в Ом/м. Хорошая электропроводность необходима, например, для токонесущих проводов (медь, алюминий). При изготовлении электронагревателей приборов и печей необходимы сплавы с высоким электросопротивлением (нихром, константан, манганин). С повышением температуры металла его электропроводность уменьшается, а с понижением - увеличивается.Магнитные свойства характеризуются абсолютной магнитной проницаемостью или магнитной постоянной, т. е. способностью металлов намагничиваться. В единицах СИ магнитная постоянная имеет размерность Гн/м. Высокими магнитными свойствами обладают железо, никель, кобальт и их сплавы, называемые ферромагнитными. Материалы с магнитными свойствами применяют в электротехнической аппаратуре и для изготовления магнитов. Химические свойства. Химические свойства характеризуют способность металлов и сплавов сопротивляться окислению или вступать в соединение с различными веществами: кислородом воздуха, растворами кислот, щелочей и др. Чем легче металл вступает в соединение с другими элементами, тем быстрее он разрушается. Химическое разрушение металлов под действием на их поверхность внешней агрессивной среды называют коррозией.Металлы, стойкие к окислению при сильном нагреве, называют жаростойкими или окалиностойкими. Такие металлы применяют для изготовления деталей, которые эксплуатируются в зоне высоких температур.Сопротивление металлов коррозии, окалинообразованию и растворению определяют по изменению массы испытуемых образцов на единицу поверхности за единицу времени.Химические свойства металлов обязательно учитываются при изготовлении тех или иных изделий. Особенно это относится к изделиям или деталям, работающим в химически агрессивных средах.
studfiles.net