- цинкование — 45-60 %
- медицина (оксид цинка как антисептик) — 10 %
- производство сплавов — 10 %
- производство резиновых шин — 10 %
- масляные краски — 10 %
- необходим для продукции спермы и мужских гормонов[9]
- необходим для метаболизма витамина E.
- важен для нормальной деятельности простаты.
- участвует в синтезе разных анаболических гормонов в организме, включая инсулин, тестостерон и гормон роста[9].
- необходим для расщепления алкоголя в организме, так как входит в состав алкогольдегидрогеназы.[9]
- ~0,25 мг/кг — яблоки, апельсины, лимоны, инжир, грейпфруты, все мясистые фрукты, зелёные овощи, минеральная вода.
- ~0,31 мг/кг — мёд.
- ~2—8 мг/кг — малина, чёрная смородина, финики, большая часть овощей, большинство морских рыб, постная говядина, молоко, очищенный рис, свёкла обычная и сахарная, спаржа, сельдерей, помидоры, картофель, редька, хлеб.
- ~8—20 мг/кг — некоторые зерновые, дрожжи, лук, чеснок, неочищенный рис, яйца.
- ~20—50 мг/кг — овсяная и ячменная мука, какао, патока, яичный желток, мясо кроликов и цыплят, орехи, горох, фасоль, чечевица, зелёный чай, сушёные дрожжи, кальмары.
- ~30—85 мг/кг — говяжья печень, некоторые виды рыб.
- ~130—202 мг/кг — отруби из пшеницы, проросшие зёрна пшеницы, тыквенные семечки, семечки подсолнечника.
- ↑ Редкол.:Зефиров Н. С. (гл. ред.) Химическая энциклопедия: в 5 т. — Москва: Большая Российская энциклопедия, 1999. — Т. 5. — С. 378.
- ↑ Hoover, Herbert Clark (2003), «Georgius Agricola de Re Metallica», Kessinger Publishing, с. 409, ISBN 0766131971
- ↑ Gerhartz, Wolfgang (1996), «Ullmann's Encyclopedia of Industrial Chemistry» (5th ed.), VHC, с. 509, ISBN 3527201009
- ↑ Крупнейшие мономинеральные месторождения (рудные районы, бассейны)
- ↑ Дальполиметалл — Wiki - Dalas
- ↑ Мир сократил производство и потребление цинка, а Китай — увеличил
- ↑ Minerals Yearbook 2006
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 Ориентировочные данные
- ↑ 1 2 3 А. В. Скальный. Цинк и здоровье человека. — РИК ГОУ ОГУ, 2003.
- ↑ Сайт «Центра биотической медицины»
Цинковые сплавы: описание, структура и свойства. Цинк это сталь
Цинковые сплавы: описание, структура и свойства
Металлы и сплавы так тесно вошли в нашу жизнь, что порой мы даже не задумываемся о них. Еще в 4-3 тысячелетиях до нашей эры произошло первое знакомство человека с самородками. С тех пор прошло много времени, и с каждым годом обработка металла только совершенствовалась.

Большую роль в этом сыграл такой металл, как цинк. Сплавы на его основе используются во многих отраслях. В данной статье мы рассмотрим цинковые сплавы и их роль в нашей жизни.
Переходный металл
Известно, что цинк – это голубовато-белый хрупкий переходный металл. Его добывают из полуметаллических руд. Процесс получения чистого цинка достаточно сложный и трудоемкий. В первую очередь руду, содержащую от 1-4% цинка, обогащают селективной флотацией. Благодаря этому процессу получают концентраты (55% Zn). Далее необходимо получить оксид цинка. Для этого в печах в кипящем слое обжигают полученные концентраты. Только из оксида цинка можно получить этот металл в чистом виде, и для этого существует два способа.
Получение цинка
Первый – электролитический, основывается на обработке оксида цинка серной кислотой. В результате этой реакции образовывается сульфатный раствор, который очищают от примесей и подвергают электролизу. На алюминиевых катодах осаживается цинк, который затем плавят в индукционных печах. Чистота цинка, полученного таким образом, составляет около 99,95%.

Второй способ, наиболее давний – дистилляционный. Концентраты нагревают до очень высокой температуры (около 1000°С), выделяются пары цинка, которые путем конденсации оседают на глиняных сосудах. Но этот способ не дает такой чистоты, как первый. В полученных парах содержится около 3% различных примесей, включая такой ценный элемент, как кадмий. Поэтому дальше Zn очищают ликвацией. При температуре 500°С его отстаивают некоторое время и получают чистоту 98%. Для дальнейшего изготовления сплавов этого достаточно, ведь потом цинк все равно легируют этими же элементами. Если этого недостаточно, применяют ректификацию и получают цинк с чистотой 99,995%. Таким образом, оба способа позволяют получить высокочистый цинк.
Неразлучная пара металлов
Как правило, свинец присутствует в составе цинковых сплавов в качестве примеси. В природе эта неразлучная пара металлов встречается достаточно часто. Но на самом деле, большое содержание свинца в цинковом сплаве ухудшает его физические свойства, создавая склонность к межкристаллитной коррозии, если его содержание превышает 0,007%. Чаще всего свинец и цинк встречаются вместе в оловянных бронзах и латуни.
Если говорить об эвтектике этих двух элементов, то важно заметить, что до температуры 800°С они не смешиваются между собой и представляют две разные жидкости. При быстром охлаждении происходит равномерное распределение Pb в виде округлых включений по границам зерен. Сплав цинк-свинец используется для изготовления типографского клише благодаря тому, что он очень быстро растворяется в кислоте. Чаще всего примеси свинца удаляют из цинка при помощи дистилляционного способа.
Сплав меди с цинком
Латунь – это сплав, известный еще до нашей эры. В те времена цинк еще не был открыт, но руда использовалась достаточно широко. Раньше получали латунь, сплавляя смитсонит (цинковую руду) и медь. Только в XVIII веке впервые изготовили этот сплав с использованием металлического цинка.

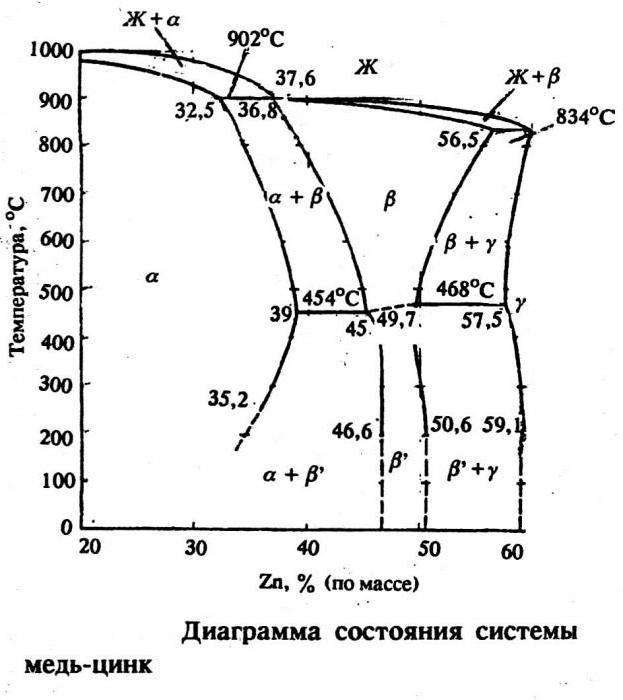
В наше время существует несколько разновидностей латуни: однофазные и двухфазные. Первые содержат в себе около 35% цинка, а вторые – 50% и 4% свинца. Однофазные латуни очень пластичны, в то время как вторая разновидность характеризуется хрупкостью и твердостью. Рассмотрев диаграмму состояния этих двух элементов, можно сделать вывод, что они образуют ряд фаз электронного вида: β, γ, ε. Интересная разновидность латуни – это томпак. Он содержит всего до 10% цинка и за счет этого отличается очень высокой пластичностью. Томпак с успехом применяется для плакирования стали и получения биметаллов. Раньше его использовали для изготовления монет и имитации золота.
Цинк и сталь
Практически в каждом доме можно встретить оцинкованные вещи: ведра, кастрюли, выварки и пр. Все они надежно защищены от ржавчины именно благодаря цинку. Образно выражаясь, конечно, на сталь наносится напыление этого металла, и по логике вещей речь не идет о сплаве. С другой стороны, зная, как происходит оцинкование, можно утверждать обратное. Дело в том, что цинк плавится при очень низкой температуре (около 400°С), а когда он в жидком состоянии попадает на поверхность стали, то диффундирует в неё.
Атомы обоих веществ очень крепко связываются между собой, образуя железоцинковый сплав. По этой причине можно смело сказать, что Zn не «уложен» на изделие, а «внедрен» в него. Это можно наблюдать в обычной бытовой ситуации. К примеру, на оцинкованном ведре появляется царапина. Начинает ли оно в этом месте ржаветь? Ответ однозначный – нет. Это происходит потому, что при попадании влаги начинают разрушаться соединения цинка, но при этом они образуют некую защиту для стали. Так, в большинстве случаев такие цинковые сплавы предназначены для защиты изделий от коррозии. Конечно, для этих целей можно использовать и другие вещества, такие как хром или никель, но стоимость этих изделий будет в разы больше.
Олово и цинк
Данный сплав не менее популярен, чем другие, уже рассмотренные нами ранее. В 1917-1918-х годах в Болгарии он широко использовался для изготовления специальных сосудов, которые держали теплую жидкость долгое время (аналоги современных термосов). В наше время сплав цинк-олово очень широко используется в радио- и электропромышленности. Это связано с тем, что состав с содержанием Zn 20% очень хорошо паяется, и полировка осадка сохраняется продолжительное время.

Конечно же, как антикоррозионное покрытие данный сплав также может быть использован. По своим характеристикам он очень похож на кадмиевое покрытие, но при этом менее дорогостоящий.
Свойства цинковых сплавов
Конечно же, все составы с этим металлом отличаются между собой его процентным содержанием. В целом цинковые сплавы имеют хорошие литейные и механические свойства. Первое и самое главное – коррозионная стойкость. Больше всего она проявляется в атмосфере сухого чистого воздуха. Возможные проявления коррозии можно заметить в промышленных городах. Это обуславливается наличием в воздухе паров соляной кислоты, хлора и оксидов серы, которые, конденсируясь влагой, затрудняют образование защитной пленки. Медь-олово-цинк – сплав, который характеризуется высокими защитными свойствами. Именно такой состав наименее подвержен коррозии, особенно в условиях промышленной атмосферы. Если говорить о литейных свойствах цинка, то, конечно же, они зависят от легирующих элементов в его сплавах.

Так, например, алюминий делает их структуру однородной, мелкозернистой, облагораживает её, уменьшает отрицательное влияние железа. Еще один важный легирующий элемент – медь. Он увеличивает прочностные характеристики и уменьшает межкристаллическую коррозию. Медно-цинковый сплав обладает высокой ударной вязкостью, но при этом частично теряет свои литейные свойства.
Области применения цинка и его сплавов
На самом деле, детали из цинковых сплавов достаточно распространены и в наше время. Несмотря на то что пластик вытесняет металлические изделия, в некоторых случаях без них не обойтись. Например, автомобилестроение – отрасль, в которой не обойтись без цинковых сплавов. Фильтры, отстойники, корпуса карбюраторов и бензонасосов, надколесные кожухи, глушители – всё это и многое другое изготавливается при помощи соединений этого химического элемента.

Благодаря тому что цинковые сплавы имеют хорошие литейные свойства, из них отливают сложные детали различных форм с минимальной толщиной стенок. Строительство – еще одна область, в которой не обойтись без этих сплавов. Цинковый прокат используют для кровельных покрытий, изготовления труб и сточных желобов. Несмотря на то что существует тенденция снижения производства цинковых сплавов, отказаться от их изготовления не представляется возможным из-за относительной дешевизны и механических свойств материала.
fb.ru
Цинк металл. Свойства, добыча и применение цинка
Свойства и происхождение цинка
Практически половина добываемого цинка уходит на покрытие других металлов. В первую очередь, это сталь и чугун.
Без «защиты» их съедает коррозия. Спасает именно цинк. Бело -голубой металл наносят на основу тонкой пленкой.
На слуху прилагательное «оцинкованный». Его часто подставляют к словам: — ведра, покрытия для крыш, проволока. В таблице химических элементов цинк находится перед железом.
Это значит, что он более активен, то есть первым вступает в реакции с воздухом.
Коррозия, как известно, вызывается именно соприкосновением влаги из атмосферы с металлом.
Металл цинк первый берет на себя удар, спасая металл, расположенный под ним. Поэтому, ведра именно оцинковывают, а не никелируют, покрывают кобальтом или оловом.
Эти элементы в таблице Менделеева расположены после железа. Они дождутся, пока этот металл разрушится и, уже потом начнут распадаться сами.
Атомный номер цинка – 30. Это цифра 2-ой группы 4-го периода таблицы химических веществ. Обозначение металла – Zn.
Он составная часть горных руд, минералов, переносится водой и, даже содержится в живых тканях.
Так, к примеру, металл активно накапливают некоторые разновидности фиалок. Но, выделить чистый цинк удалось лишь в 18-ом столетии.
Сделал это немец Андреас Сигизмунд Маргграф. Он прокалил смесь оксида цинка с углем.
Опыт удался, потому что проводился без доступа воздуха, то есть кислорода. Резервуаром для реакции стал огнеупорный сосуд из глины.
Полученные металлические пары химик поместил в холодильник. Под воздействием низких температур частицы цинка осели на его стенки.
Месторождения и добыча цинка
Теперь же каждый год в мире добывают около 10-ти миллионов тонн голубоватого металла в чистом виде. Его содержание в земной коре 6-9%.
Проценты эти распределили между собой 50 стран. В лидерах Перу, США, Канада, Узбекистан, Россия, но больше всего месторождений цинка в Австралии и Китае.
На каждую из этих стран приходится примерно 3 десятка миллионов тонн металла с порядковым номером 30.
Однако, в будущем на первое место в рейтинге может встать океан. Основные запасы цинка сосредоточенны в его водах, на его дне.
Разрабатывать, правда, морское месторождение еще не научились. Технологии есть, но они слишком дорогостоящие.
Поэтому практически 3 миллиона тонн цинка так и лежат на дне Красного моря, не говоря уже о запасах Карибского бассейна и Срединно-Атлантического хребта.
Применение цинка
Цинк нужен ювелирам. Металл добавляют в сплавы на основе золота. Минимальные дозы цинка делают их тягучими, легко поддающимися ковке, послушными в руках мастера.
30-ый элемент также осветляет изделие, поэтому часто используется для создания, так называемого, белого золота.
Однако, с цинком главное не переборщить. Даже 3 десятых содержания металла в сплаве сделает украшение непрочным, хрупким.
Снижает белый металл и температуру плавления сплава. Соединения меди с цинком, открытые, еще в древнем Египте, применяют в производстве бижутерии. Сплав дешевый, легко поддается обработке, привлекательно выглядит.
Из-за невысокой температуры плавления цинк стал «героем» микросхем и всевозможных припоев.
Он, как и олово, легко и прочно соединяет мелкие детали между собой. При низких температурах металл хрупок, но уже при 100-150 градусах становится тягучим, податливым.
Этим физическим свойством цинка и пользуются промышленники и мастера кустарного производства.
Интересно, что при еще большем накале, к примеру, до 500-та градусов, элемент снова превращается в ломкий и ненадежный.
Низкая планка плавления финансово выгодна промышленникам. Топлива надо меньше, переплачивать за дорогостоящее оборудование нет необходимости.
Экономят и на обработке полученных «отливок» из цинка. Их поверхность зачастую даже не требует дополнительной полировки.
Металл активно используют в автомобильной отрасли. Сплавы на основе цинка идут на ручки дверей, кронштейны, декор салона, замки, оформление зеркал, корпуса стеклоочистителей.
В автомобильном сплаве цинка высок процент алюминия. Последний, делает соединение более износостойким и прочным.
Окись цинка добавляют в автомобильные покрышки. Без нее резина получается низкого качества.
Ведущую роль в экономике многих стран играют чугун и латунь. Их производство немыслимо без цинка. В латуни его от 30-ти до 50-ти процентов (в зависимости от разновидности сплава).
Латунь идет не только на дверные ручки. Из нее изготавливают и посуду, оправы для магнитов, смесителей и высокотехнического оборудования для заводов разных профилей.
Широко используют и цинковые листы. Они – основа печатных форм в полиграфии.
Листы идут на изготовление источников тока, труб, покрытий для крыш и желобов для сточных вод.
Цинк – составная часть многих красителей. Так, окись цинка используют как белую краску. Кстати, именно такое покрытие используют в космонавтике.
Для ракет, спутников необходимы красители отражающие свет, а это лучше всего делают составы на основе цинка.
Он незаменим и в деле борьбы с радиацией. Под ее лучами сульфид металла вспыхивает, выдавая присутствие опасных частиц.
Позарились на элемент цинк и фармацевты. Цинк – антисептик. Его добавляют в мази для новорожденных, заживляющие составы.
Более того, некоторые медики уверены, что цинк, вернее, его недостаток, вызывает шизофрению.
Поэтому, заклинают врачи, обязательно надо употреблять продукты, содержащие металл.
Больше всего цинка в морепродуктах. Не зря же залежи металла хранятся в океанских глубинах.
tvoi-uvelirr.ru
Популярная библиотека химических элементов. Раритетные издания. Наука и техника
Цинк
| 30 | |
Zn |
2 18 8 2 |
| ЦИНК | |
| 65,38 | |
| 3d104s2 | |
Рассказ об элементе №30 – цинке – мы вопреки традиции начнем не с истории его открытия, а с самого важного его применения. Это тем более оправданно, что история цинка не отличается точностью дат. А по значению, это несомненно один из важнейших цветных металлов.
Свидетельством первостепенной важности цинка выступает его дешевизна: на мировом рынке (данные 1960 г.) цинк – третий от конца среди всех металлов. Дешевле его лишь железо и свинец. Дешевизна цинка – 0,29 доллара за килограмм – результат больших масштабов его производства. Ведь и карандаш, к примеру, сделать совсем не просто, но изготовляемые миллионами штук карандаши стоят копейки. Так и с циаком: не «хорош, потому что дешев», а «дешев, потому что хорош».
Цинк и сталь
Как бы громко ни называли наше время: «век полимеров», «век полупроводников», «атомный век» и так далее по сути дела мы не вышли еще из века железного. Этот металл по-прежнему остается основой промышленности. По выплавке чугуна и стали и сейчас судят о мощи государства. А чугун и сталь подвержены коррозии, и, несмотря на значительные успехи, достигнутые человечеством в борьбе с «рыжим врагом», коррозия ежегодно губит десятки миллионов тонн металла.
Нанесение на поверхность стали и чугуна тонких пленок коррозионно-стойких металлов – важнейшее средство защиты от коррозии. А на первом месте среди всех металлопокрытий – и по важности, и по масштабам – стоят покрытия цинковые. На защиту стали идет 40% мирового производства цинка!
Оцинкованные ведра, оцинкованная жесть на крышах домов – вещи настолько привычные, настолько будничные, что мы, как правило, не задумываемся, а почему, собственно, они оцинкованные, а не хромированные или никелированные? Если же такой вопрос возникает, то «железная логика» мигом выдает однозначный ответ: потому что цинк дешевле хрома и никеля. Но дело не в одной дешевизне.
Цинковое покрытие часто оказывается более надежным, нежели остальные, потому что цинк не просто механически защищает железо от внешних воздействий, он его химически защищает.
Кобальт, никель, кадмий, олово и другие металлы, применяемые для защиты железа от коррозии, в ряду активности металлов стоят после железа. Это значит, что они химически более стойки, чем железо. Цинк же и хром, наоборот, активнее железа. Хром в ряду активности стоит почти рядом с железом (между ними только галлий), а цинк – перед хромом.
Процессы атмосферной коррозии имеют электрохимическую природу и объясняются с электрохимических позиций. Но в принципе механизм защиты железа цинком состоит в том, что цинк – металл более активный – прежде, чем железо, реагирует с агрессивными компонентами атмосферы. Получается, словно металлы соблюдают правило солдатской дружбы: сам погибай, а товарища выручай... Конечно, металлы не солдаты, тем не менее, цинк выручает железо, погибая.
Вот как это происходит.
В присутствии влаги между железом и цинком образуется микрогальванопара, в которой цинк – анод. Именно он и будет разрушаться при возникшем электрохимическом процессе, сохраняя в неприкосновенности основной металл. Даже если покрытие нарушено – появилась, допустим, царапина, – эти особенности цинковой защиты и ее надежность остаются неизменными. Ведь и в такой ситуации действует микрогальванопара, в которой цинк принесен в жертву, и, кроме того, обычно в процессе нанесения покрытия железо и цинк реагируют между собой. И чаще всего царапина оголяет не само железо, а интерметаллическое соединение железа с цинком, довольно устойчивое к действию влаги.
Существен и состав продукта, образующегося при «самопожертвований» элемента №30. Активный цинк реагирует с влагой воздуха и одновременно с содержащимся в нем углекислым газом. Образуется защитная пленка состава 2ZnCO3 · Zn(OH)2, имеющая достаточную химическую стойкость, чтобы защитить от реакций и железо, и сам цинк. Но если цинк коррелирует в среде, лишенной углекислоты, скажем, в умягченной воде парового котла, то пленка нужного состава образоваться не может, и в этом случае цинковое покрытие разрушается намного быстрее.
Как же наносят цинк на железо? Способов несколько. Поскольку цинк образует сплавы с железом, быстро растворяя его даже при невысоких температурах, можно наносить распыленный цинк на подготовленную стальную поверхность из специального пистолета. Можно оцинковывать сталь (это самый старый способ), просто окуная ее в расплавленный цинк. Кстати, плавится он при сравнительно низкой температуре (419,5°C). Есть, конечно, электролитические способы цинкования. Есть, наконец, метод шерардизации (по имени изобретателя) применяемый для покрытия небольших деталей сложной конфигурации, когда особенно важно сохранить неизменными размеры.
В герметически закрытом барабане детали, пересыпанные цинковой пылью, выдерживают в течение нескольких часов при 350...375°C. В этих условиях атомы цинка достаточно быстро диффундируют в основной материал; образуется железоцинковый сплав, слой которого не «уложен» поверх детали, а «внедрен» в нее.
Сплавы и немного истории
Уже упоминалось, что история элемента с атомным номером 30 достаточно путана. Но одно бесспорно: сплав меди и цинка – латунь – был получен намного раньше, чем металлический цинк. Самые древние латунные предметы, сделанные примерно в 1500 г. до н.э., найдены при раскопках в Палестине.
Приготовление латуни восстановлением особого камня – χαδμεια (кадмея) углем в присутствии меди описано у Гомера, Аристотеля, Плиния Старшего. В частности, Аристотель писал о добываемой в Индии меди, которая «отличается от золота только вкусом».
Действительно, в довольно многочисленной группе сплавов, носящих общее название латуней, есть один (Л-96, или томпак), по цвету почти неотличимый от золота. Между прочим, томпак содержит меньше цинка, чем большинство латуней: цифра за индексом Л означает процентное содержание меди. Значит, на долю цинка в этом сплаве приходится не больше 4%.
Можно предполагать, что металл из кадмеи и в древности добавляли в медь не только затем, чтобы осветлить ее. Меняя соотношение цинка и меди, можно получить многочисленные сплавы с различными свойствами. Не случайно латуни поделены на две большие группы – альфа и бета-латуни. В первых цинка не больше 33%.
С увеличением содержания цинка пластичность латуни растет, но только до определенного предела: латунь с 33 и более процентами цинка при деформировании в холодном состоянии растрескивается; 33%Zn – рубеж роста пластичности, за которым латунь становится хрупкой.
Впрочем, могло случиться, что за основу классификации латуней взяли бы другой «порог» – все классификации условны, ведь и прочность латуней растет по мере увеличения в них содержания цинка, но тоже до определенного предела. Здесь предел иной – 47...50% Zn. Прочность латуни, содержащей 45% Zn, в несколько раз больше, чем сплава, отлитого из равных количеств цинка и меди.
Широчайший диапазон свойств латуней объясняется прежде всего хорошей совместимостью меди и цинка: они образуют серию твердых растворов с различной кристаллической структурой. Так же разнообразно и применение сплавов этой группы. Из латуней делают конденсаторные трубки и патронные гильзы, радиаторы и различную арматуру, множество других полезных вещей – всего не перечислить.
И что здесь особенно важно. Введенный в разумных пределах цинк всегда улучшает механические свойства меди (ее прочность, пластичность, коррозионную стойкость). И всегда при этом он удешевляет сплав – ведь цинк намного дешевле меди. Легирование делает сплав более дешевым – такое встретишь не часто.
Цинк входит и в состав другого древнего сплава на медной основе. Речь идет о бронзе. Это раньше делили четко: медь плюс олово – бронза, медь плюс цинк – латунь. Теперь «грани стерлись». Сплав ОЦС-3-12-5 считается бронзой, но цинка в нем в четыре раза больше, чем олова. Бронза для отливки бюстов и статуй содержит (марка БХ-1) от 4 до 7% олова и от 5 до 8% цинка, т.е. называть ее латунью оснований больше – на 1%. А ее по-прежнему называют бронзой, да еще художественной...
До сих пор мы рассказывали только о защите цинком и о легировании цинком. Но есть и сплавы на основе элемента №30. Хорошие литейные свойства и низкие температуры плавления позволяют отливать из таких сплавов сложные тонкостенные детали. Даже резьбу под болты и гайки можно получать непосредственно при отливке, если имеешь дело со сплавами на основе цинка.
Растущий дефицит свинца и олова заставил металлургов искать рецептуры новых типографских и антифрикционных сплавов. Доступный, довольно мягкий и относительно легкоплавкий цинк, естественно, привлек внимание в первую очередь. Почти 30 лет поисковых и исследовательских работ предшествовали появлению антифрикционных сплавов на цинковой основе. При небольших нагрузках они заметно уступают и баббитам и бронзам, но в подшипниках большегрузных автомобилей и железнодорожных вагонов, угледробилок и землечерпалок они стали вытеснять традиционные сплавы. И дело здесь не только в относительной дешевизне сплавов на основе цинка. Эти материалы прекрасно выдерживают большие нагрузки при больших скоростях в условиях, когда баббиты начинают выкрашиваться...
Цинковые сплавы появились и в полиграфии. Так, наряду с сурьмяно-оловянно-свинцовым сплавом – гартом для отливки шрифтов используют и так называемый сплав №3, в котором содержится до 3% алюминия, 1,2...1,6% магния, остальное цинк. К роли цинка в полиграфии мы еще вернемся в рассказе о металлическом цинке.
Металлический цинк и снова немного истории
Когда впервые был выплавлен металлический цинк, точно не установлено. Известно, что в Индии его получали еще в V в. до н.э. Получение металлического цинка (под названием тутии или фальшивого серебра) описано у римского историка Страбопа (60...20 годы до н.э.). Позже, однако, искусство выплавки цинка в Европе было утрачено. Правда, цинк ввозили из стран Востока, но в очень небольших количествах, и до середины XVIII в. он оставался редкостью.
Лишь в 1743 г. в Бристоле заработал первый в Европе цинковый завод. А ведь еще в конце XIII в. Марко Поло описывал, как получают этот металл в Персии. Крупнейшие ученые XVI в. Парацельс и Агрикола в своих трудах уделяли место выплавке цинка. В том же XVI в. были предприняты первые попытки выплавлять его в заводских условиях. Но производство «не пошло», технологические трудности оказались непреодолимыми. Цинк пытались получать точно так же, как и другие металлы. Руду обжигали, превращая цинк в окись, затем эту окись восстанавливали углем...
Цинк, естественно, восстанавливался, взаимодействуя с углем, но... не выплавлялся. Не выплавлялся потому, что этот металл уже в плавильной печи испарялся – температура его кипения всего 906°C. А в печи был воздух. Встречая его, пары активного цинка реагировали с кислородом, и вновь образовывался исходный продукт – окись цинка.
Наладить цинковое производство в Европе удалось лишь после того, как руду стали восстанавливать в закрытых ретортах без доступа воздуха. Примерно так же «черновой» цинк получают и сейчас, а очищают его рафинированием. Пирометаллургическим способом сейчас получают примерно половину производимого в мире цинка, а другую половину – гидрометаллургическим.
Следует иметь в виду, что чисто цинковые руды в природе почти, но встречаются. Соединения цинка (обычно 1...5% в пересчете на металл) входят в состав полиметаллических руд. Полученные при обогащении руды цинковые концентраты содержат 48...65% Zn, до 2% меди, до 2% свинца, до 12% железа. И плюс доли процента рассеянных и редких металлов...
Сложный химический и минералогический состав руд, содержащих цинк, был одной из причин, по которым цинковое производство рождалось долго и трудно. В переработке полиметаллических руд и сейчас еще есть нерешенные проблемы... Но вернемся к пирометаллургии элемента №30 – в этом процессе проявляются сугубо индивидуальные особенности этого элемента.
При резком охлаждении пары цинка сразу же, минуя жидкое состояние, превращаются в твердую пыль. Это несколько осложняет производство, хотя элементарный цинк считается нетоксичным. Часто бывает нужно сохранить цинк именно в виде пыли, а не переплавлять его в слитки.
В пиротехнике цинковую пыль применяют, чтобы получить голубое пламя. Цинковая пыль используется в производстве редких и благородных металлов. В частности, таким цинком вытесняют золото и серебро из цианистых растворов. Как ни парадоксально, но и при получении самого цинка (и кадмия) гидрометаллургическим способом применяется цинковая пыль – для очистки раствора сульфата цинка от меди и кадмия. Но это еще не все. Вы никогда не задумывались, почему металлические мосты, пролеты заводских цехов и другие крупногабаритные изделия из металла чаще всего окрашивают в серый цвет?
Главная составная часть применяемой во всех этих случаях краски – все та же цинковая пыль. Смешанная с окисью цинка и льняным маслом, она превращается в краску, которая отлично предохраняет от коррозии. Эта краска к тому же дешева, эластична, хорошо прилипает к поверхности металла и не отслаивается при температурных перепадах.
Мышиный цвет тоже скорее достоинство, чем недостаток. Изделия, которые покрывают такой краской, должны быть немарки и в то же время опрятны.
На свойствах цинка сильно сказывается степень его чистоты. При 99,9 и 99,99% чистоты цинк хорошо растворяется в кпслотах. Но стоит «прибавить» еще одну девятку (99,999%), и цинк становится нерастворимым в кислотах даже при сильном нагревании. Цпнк такой чистоты отличается и большой пластичностью: его можно вытягивать в тонкие нити. А обычпый цинк можно ппокатать в тонкие листы, лишь нагрев его до 100...150°C. Нагретый до 250°C и выше, вплоть до точки плавления, цинк опять становится хрупким – происходит очередная перестройка его кристаллической структуры.
Листовой цинк широко применяют в производстве гальванических элементов. Первый «вольтов столб» состоял из кружочков цинка и меди. И в современных химических источниках тока отрицательный электрод чаще всего делается из элемента №30.
Значительна роль этого элемента в полиграфии. Мы уже упоминали о типографских сплавах на основе цинка, но главное в другом. Из цинка делают клише, позволяющие воспроизвести в печати рисунки и фотографии. Специально приготовленный и обработанный типографский цинк воспринимает фотоизображение. Это изображение в нужных местах защищают краской, и будущее клише протравливают кислотой. Изображение приобретает рельефность, опытные граверы подчищают его, делают пробные оттиски, а потом эти клише идут в печатные машины.
К полиграфическому цинку предъявляют особые требования: прежде всего он должен иметь мелкокристаллическую структуру, особенно на поверхности слитка. Поэтому цинк, предназначенный для полиграфии, всегда отливают в закрытые формы. Для «выравнивания» структуры применяют отжиг при 375°C с последующим медленным охлаждением и горячей прокаткой. Строго лимитируют и присутствие в таком металле примесей, особенно свинца. Если его много, то нельзя будет вытравить клише так, как это нужно. Если же свинца меньше 0,4%, то трудно получить нужную мелкокристаллическую структуру. Вот по этой кромке и «ходят» металлурги, стремясь удовлетворить запросы полиграфии.
Коротко о соединениях цинка
Еще при первых попытках выплавить цинк из руды у средневековых химиков получался белый налет, который в книгах того времени называли двояко: либо «белым снегом (nix alba), либо «философской птерстью» (lana philosophica). Нетрудно догадаться, что это была окись цинка ZnO – вещество, которое есть в жилище каждого городского жителя наших дней.
Этот «снег», будучи замешанным на олифе, превращается в цинковые белила – самые распространенные пз всех белил. Окись цинка нужна не только для малярных дел, ею широко пользуются многие отрасли промышленности. Стекольная – для получения молочного стекла и (в малых дозах) для увеличения термостойкости обычных стекол. В резиновой промышленности и производстве линолеума окись цинка используют как наполнитель. Известная цинковая мазь на самом деле не цинковая, а окисноцинковая. Препараты на основе ZnO эффективны при кожных заболеваниях.
Наконец, с кристаллической окисью цинка связана одна из самых больших научных сенсаций 20-х годов нашего века. В 1924 г. один из радиолюбителей города Томска установил рекорд дальности приема. Детекторным приемником он в Сибири принимал передачи радиостанций Франции и Германии, причем слышимость была более отчетливой, чем у владельцев одноламповых приемников. Как это могло произойти? Дело в том, что детекторный приемник томского любителя был смонтирован по схеме сотрудника нижегородской радиолаборатории О.В. Лосева.
Лосев установил, что если в колебательный контур определенным образом включен кристалл окиси цинка, то последний будет усиливать колебания высокой частоты и даже возбуждать незатухающие колебания, В наши «веселые транзисторные дни» такое событие прошло бы почти незамеченным, но в 1924 г. изобретение Лосева представлялось революционным. Вот что говорилось в редакционной статье американского журнала «Radio-News», целиком посвященной работе нижегородского изобретателя: «Изобретение О.В. Лосева из Государственной радиоэлектрической лаборатории в России делает эпоху, и теперь кристалл заменит лампу!»
Автор статьи оказался провидцем: кристалл действительно заменил лампу; правда, это не лосевский кристалл окиси цинка, а кристаллы других веществ. Но, между прочим, среди широко применяемых полупроводниковых материалов есть соединения цинка. Это его селениды и теллуриды, антимопид и арсенид.
Еще более важно применение некоторых соединении цинка, прежде всего его сульфида, для покрытия светящихся экранов телевизоров, осциллографов, рентгеновских аппаратов. Под действием коротковолнового излучения или электронного луча сернистый цинк приобретает способность светиться, причем эта способность сохраняется и после того, как прекратилось облучение.
Резерфорд, впервые столкнувшись с явлением послесвечения сернистого цинка, воспользовался им для подсчета вылетающих из ядра альфа-частиц. В несложном приборчике, спинтарископе, ударяясь об экран, покрытый сульфидом цинка, эти частицы высекали вспышку, видимую глазом. А если частицы падают на экран достаточно часто, то вместо вспышек появляется постоянное свечение.
Биологическая роль цинка
Фармацевты и медики жалуют многие соединения элемента №30. Со времен Парацельса до наших дней в фармакопее значатся глазные цинковые капли (0,25%-ный раствор ZnSO4). Как присыпка издавна применяется цинковая соль стеариновой кислоты. Фенолсульфонат цинка – хороший антисептик. Суспензия, в которую входят инсулин, протамин и хлорид цинка – эффективное средство против диабета, действующее лучше, чем чистый инсулин.
И вместе с тем многие соединения цинка, прежде всего его сульфат и хлорид, токсичны.
Цинк – один из важных микроэлементов. И в то же время избыток цинка для растений вреден.
Биологическая роль цинка двояка и не до конца выяснена. Установлено, что цинк – обязательная составная часть фермента крови карбоангидразы. Этот фермент содержится в эритроцитах. Карбоангидраза ускоряет выделение углекислого газа в легких. Кроме того, она помогает превратить часть CO2 в ион НCO3–, играющий важную роль в обмене веществ.
Но вряд ли только карбоангидразой ограничивается роль цинка в жизни животных и человека. И если бы было так, то трудно было бы объяснить токсичность соединений элемента №30.
Известно, что довольно много цинка содержится в яде змей, особенно гадюк и кобр. Но в то же время известно, что соли цинка специфически угнетают активность этих же самых ядов; как показали опыты, под действием солей цинка яды не разрушаются. Как объяснить такое противоречие? Считают, что высокое содержание цинка в яде – это то средство, которым змея от собственного яда защищается. Но такое утверждение еще требует строгой экспериментальной проверки. Ждут выяснения и многие другие детали общей проблемы «цинк и жизнь»...
Что можно сказать в заключение об элементе №30. Только одно: элемент этот не очень эффектный (как не очень эффектно и цинковое покрытие). Но для всех нас он разносторонне важен.
Бурундучная руда
Наиболее распространенный минерал цинка – сфалерит, или цинковая обманка ZnS. Разнообразные примеси придают этому веществу всевозможные цвета. Видимо, за это минерал и называют обманкой. Цинковую обманку считают первичным минералом, из которого образовались другие минералы элемента №30: смитсонит ZnCO3, цинкит ZnO, каламин 2ZnO · SiO2 · Н2O. На Алтае нередко можно встретить полосатую «бурундучную» руду – смесь цинковой обманки и бурого шпата. Кусок такой руды издали действительно похож на затаившегося полосатого зверька.
Слово «цинк»
Латинское zincum переводится как «белый налет». Откуда пошло это слово, точно не установлено. Некоторые историки науки и лингвисты считают, что оно идет от персидского «ченг», хотя это название относится не к цинку, а вообще к камням. Другие связывают его с древнегерманским «цинко», означавшим, в частности, бельмо на глазу.
За многие века знакомства человечества с цинком название его неоднократно менялось: «спелтер», «тутия», «шпиаутер»... Общепризнанным название «цинк» стало лишь в 20-х годах нашего столетия.
Цинковый чемпион
Во всяком деле есть свой чемпион: чемпион по бегу, по боксу, по танцам, по скоростной варке пищи, по отгадыванию кроссвордов... С именем Чемпиона (Чемпиона с большой буквы) связана история первых в Европе цинковых производств. На имя Джона Чемпиона был выдан патент на дистилляционный способ получения цинка из окисленных руд. Случилось это в 1739 г., а к 1743 г. был построен завод в Бристоле с ежегодной продукцией 200 т цинка. Через 19 лет тот же Д. Чемпион запатентовал способ получения цинка из сульфидных руд.
Не в ночь под Ивана Купалу
По старинным преданиям, папоротник цветет лишь в ночь под Ивана Купалу и охраняет этот цветок нечистая сила. В действительности папоротник как споровое растение не цветет вообще, но слова «папоротниковые цветы» можно встретить на страницах вполне серьезных научных журналов. Так называют характерные узоры цинковых покрытий. Эти узоры возникают благодаря специальным добавкам сурьмы (до 0,3%) или олова (до 0,5%), которые вводят в ванны горячего пинкования. На некоторых заводах «цветы» получают иначе, – прижимая горячий оцинкованный лист к рифленому транспортеру.
Не батарея, но аккумулятор
Первый в мире электромотор был сконструирован академиком Б.С. Якоби. В 1838 г. всеобщее восхищение вызвал его электроход – лодка с электрическим двигателем, возившая вверх и вниз по Неве до 14 пассажиров. Мотор получал ток от гальванических батарей. В хоре восторженных откликов диссонансом прозвучало мнение известного немецкого химика Юстуса Либиха: «Гораздо выгоднее прямо сжигать уголь для получения теплоты или работы, чем расходовать этот уголь на добывание цинка, а затем уже сжиганием его в батареях получать работу в электродвигателях». В конечном счете Либих оказался прав наполовину: как источник питания электродвигателей батареи скоро перестали применять. Их заменили аккумуляторами, способными восполнять запасы энергии. В аккумуляторах до последнего времени цинк не применяли. Лишь в наши дни появились аккумуляторы с электродами из серебра и цинка. В частности, такой аккумулятор работал на борту третьего советского искусственного спутника Земли.
• Галлий
• Оглавление
Дата публикации:
28 июня 2002 года
n-t.ru
Цинк - это... Что такое Цинк?
| Хрупкий металл голубовато-белого цвета | |
| Цинк / Zincum (Zn), 30 | |
| 65,39 а. е. м. (г/моль) | |
| [Ar] 3d10 4s2 | |
| 138 пм | |
| 125 пм | |
| (+2e) 74 пм | |
| 1,65 (шкала Полинга) | |
| -0,76 В | |
| =+2 | |
| 905,8(9,39) кДж/моль (эВ) | |
| 7,133 г/см³ | |
| 419,6 °C | |
| 906,2 °C | |
| 7,28 кДж/моль | |
| 114,8 кДж/моль | |
| 25,4[1] Дж/(K·моль) | |
| 9,2 см³/моль | |
| гексагональная | |
| a=2,6648 c=4,9468 Å | |
| 1,856 | |
| 234 K | |
| (300 K) 116 Вт/(м·К) | |
Цинк — элемент побочной подгруппы второй группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 30. Обозначается символом Zn (лат. Zincum). Простое вещество цинк (CAS-номер: 7440-66-6) при нормальных условиях — хрупкий переходный металл голубовато-белого цвета (тускнеет на воздухе, покрываясь тонким слоем оксида цинка).
История
Сплав цинка с медью — латунь — был известен ещё в Древней Греции, Древнем Египте, Индии (VII в.), Китае (XI в.). Долгое время не удавалось выделить чистый цинк. В 1746 А. С. Маргграф разработал способ получения чистого цинка путём прокаливания смеси его окиси с углём без доступа воздуха в глиняных огнеупорных ретортах с последующей конденсацией паров цинка в холодильниках. В промышленном масштабе выплавка цинка началась в XVII в.
Происхождение названия
Слово «цинк» впервые встречается в трудах Парацельса, который назвал этот металл словом «zincum» или «zinken» в книге Liber Mineralium II[2]. Это слово, вероятно, восходит к нем. Zinke, означающее «зубец» (кристаллиты металлического цинка похожи на иглы)[3].
Нахождение в природе
Известно 66 минералов цинка, в частности цинкит, сфалерит, виллемит, каламин, смитсонит, франклинит. Наиболее распространенный минерал — сфалерит, или цинковая обманка. Основной компонент минерала — сульфид цинка ZnS, а разнообразные примеси придают этому веществу всевозможные цвета. Из-за трудности определения этого минерала его называют обманкой (др.-греч. σφαλερός — обманчивый). Цинковую обманку считают первичным минералом, из которого образовались другие минералы элемента № 30: смитсонит ZnCO3, цинкит ZnO, каламин 2ZnO · SiO2 · Н2O. На Алтае нередко можно встретить полосатую «бурундучную» руду — смесь цинковой обманки и бурого шпата. Кусок такой руды издали действительно похож на затаившегося полосатого зверька.
Среднее содержание цинка в земной коре — 8,3·10-3%, в основных извержённых породах его несколько больше (1,3·10-2%), чем в кислых (6·10-3%). Цинк — энергичный водный мигрант, особенно характерна его миграция в термальных водах вместе со свинцом. Из этих вод осаждаются сульфиды цинка, имеющие важное промышленное значение. Цинк также энергично мигрирует в поверхностных и подземных водах, главным осадителем для него является сероводород, меньшую роль играет сорбция глинами и другие процессы.
Цинк — важный биогенный элемент, в живых организмах содержится в среднем 5·10-4% цинка. Но есть и исключения — так называемые организмы-концентраторы (например, некоторые фиалки).
Месторождения
Месторождения цинка известны в Австралии, Боливии[4]. В России крупнейшим производителем свинцово-цинковых концентратов является ОАО "ГМК Дальполиметалл"[5][неавторитетный источник? 156 дней].
Получение
Цинк в природе как самородный металл не встречается. Цинк добывают из полиметаллических руд, содержащих 1-4 % Zn в виде сульфида, а также Cu, Pb, Ag, Au, Cd, Bi. Руды обогащают селективной флотацией, получая цинковые концентраты (50-60 % Zn) и одновременно свинцовые, медные, а иногда также пиритные концентраты. Цинковые концентраты обжигают в печах в кипящем слое, переводя сульфид цинка в оксид ZnO; образующийся при этом сернистый газ SO2 расходуется на производство серной кислоты. Чистый цинк из оксида ZnO получают двумя способами. По пирометаллургическому (дистилляционному) способу, существующему издавна, обожженный концентрат подвергают спеканию для придания зернистости и газопроницаемости, а затем восстанавливают углем или коксом при 1200—1300 °C: ZnO + С = Zn + CO. Образующиеся при этом пары металла конденсируют и разливают в изложницы. Сначала восстановление проводили только в ретортах из обожженной глины, обслуживаемых вручную, позднее стали применять вертикальные механизированные реторты из карборунда, затем — шахтные и дуговые электропечи; из свинцово-цинковых концентратов цинк получают в шахтных печах с дутьем. Производительность постепенно повышалась, но цинк содержал до 3 % примесей, в том числе ценный кадмий. Дистилляционный цинк очищают ликвацией (то есть отстаиванием жидкого металла от железа и части свинца при 500 °C), достигая чистоты 98,7 %. Применяющаяся иногда более сложная и дорогая очистка ректификацией дает металл чистотой 99,995 % и позволяет извлекать кадмий.
Основной способ получения цинка — электролитический (гидрометаллургический). Обожженные концентраты обрабатывают серной кислотой; получаемый сульфатный раствор очищают от примесей (осаждением их цинковой пылью) и подвергают электролизу в ваннах, плотно выложенных внутри свинцом или винипластом. Цинк осаждается на алюминиевых катодах, с которых его ежесуточно удаляют (сдирают) и плавят в индукционных печах. Обычно чистота электролитного цинка 99,95 %, полнота извлечения его из концентрата (при учете переработки отходов) 93-94 %. Из отходов производства получают цинковый купорос, Pb, Cu, Cd, Au, Ag; иногда также In, Ga, Ge, Tl.
Физические свойства
В чистом виде — довольно пластичный серебристо-белый металл. Обладает гексагональной решеткой с параметрами а = 0,26649 нм, с = 0,49431 нм, пространственная группа P 63/mmc, Z = 2. При комнатной температуре хрупок, при сгибании пластинки слышен треск от трения кристаллитов (обычно сильнее, чем «крик олова»). При 100—150 °C цинк пластичен. Примеси, даже незначительные, резко увеличивают хрупкость цинка. Собственная концентрация носителей заряда в цинке 13,1·1028 м−3
Химические свойства
Типичный пример металла, образующего амфотерные соединения. Амфотерными являются соединения цинка ZnO и Zn(OH)2. Стандартный электродный потенциал −0,76 В, в ряду стандартных потенциалов расположен до железа.
На воздухе цинк покрывается тонкой пленкой оксида ZnO. При сильном нагревании сгорает с образованием амфотерного белого оксида ZnO:
Оксид цинка реагирует как с растворами кислот:
так и щелочами:
Цинк обычной чистоты активно реагирует с растворами кислот:
и растворами щелочей:
образуя гидроксоцинкаты. С растворами кислот и щелочей очень чистый цинк не реагирует. Взаимодействие начинается при добавлении нескольких капель раствора сульфата меди CuSO4.
При нагревании цинк реагирует с галогенами с образованием галогенидов ZnHal2. С фосфором цинк образует фосфиды Zn3P2 и ZnP2. С серой и её аналогами — селеном и теллуром — различные халькогениды, ZnS, ZnSe, ZnSe2 и ZnTe.
С водородом, азотом, углеродом, кремнием и бором цинк непосредственно не реагирует. Нитрид Zn3N2 получают реакцией цинка с аммиаком при 550—600 °C.
В водных растворах ионы цинка Zn2+ образуют аквакомплексы [Zn(h3O)4]2+ и [Zn(h3O)6]2+.
Применение
Чистый металлический цинк используется для восстановления благородных металлов, добываемых подземным выщелачиванием (золото, серебро). Кроме того, цинк используется для извлечения серебра, золота (и других металлов) из чернового свинца в виде интерметаллидов цинка с серебром и золотом (так называемой «серебристой пены»), обрабатываемых затем обычными методами аффинажа.
Применяется для защиты стали от коррозии (оцинковка поверхностей, не подверженных механическим воздействиям, или металлизация — для мостов, емкостей, металлоконструкций).
Цинк используется в качестве материала для отрицательного электрода в химических источниках тока, то есть в батарейках и аккумуляторах, например: марганцево-цинковый элемент, серебряно-цинковый аккумулятор (ЭДС 1,85 В, 150 Вт·ч/кг, 650 Вт·ч/дм³, малое сопротивление и колоссальные разрядные токи), ртутно-цинковый элемент (ЭДС 1,35 В, 135 Вт·ч/кг, 550—650 Вт·ч/дм³), диоксисульфатно-ртутный элемент, йодатно-цинковый элемент, медно-окисный гальванический элемент (ЭДС 0,7—1,6 Вольт, 84—127 Вт·ч/кг, 410—570 Вт·ч/дм³), хром-цинковый элемент, цинк-хлоросеребряный элемент, никель-цинковый аккумулятор (ЭДС 1,82 Вольт, 95—118 Вт·ч/кг, 230—295 Вт·ч/дм³), свинцово-цинковый элемент, цинк-хлорный аккумулятор, цинк-бромный аккумулятор и др.
Очень важна роль цинка в цинк-воздушных аккумуляторах, которые отличаются весьма высокой удельной энергоёмкостью. Они перспективны для пуска двигателей (свинцовый аккумулятор — 55 Вт·ч/кг, цинк-воздух — 220—300 Вт·ч/кг) и для электромобилей (пробег до 900 км).
Цинк вводится в состав многих твёрдых припоев для снижения их температуры плавления.
Окись цинка широко используется в медицине как антисептическое и противовоспалительное средство. Также окись цинка используется для производства краски — цинковых белил.
Цинк — важный компонент латуни. Сплавы цинка с алюминием и магнием (ЦАМ, ZAMAK) благодаря сравнительно высоким механическим и очень высоким литейным качествам очень широко используются в машиностроении для точного литья. В частности, в оружейном деле из сплава ZAMAK (-3, -5) иногда отливают затворы пистолетов, особенно рассчитанных на использование слабых или травматических патронов. Также из цинковых сплавов отливают всевозможную техническую фурнитуру, вроде автомобильных ручек, корпусы карбюраторов, масштабные модели и всевозможные миниатюры, а также любые другие изделия, требующие точного литья при приемлемой прочности.
Хлорид цинка — важный флюс для пайки металлов и компонент при производстве фибры.
Сульфид цинка используется для синтеза люминофоров временного действия и разного рода люминесцентов на базе смеси ZnS и CdS. Люминофоры на базе сульфидов цинка и кадмия, также применяются в электронной промышленности для изготовления светящихся гибких панелей и экранов в качестве электролюминофоров и составов с коротким временем высвечивания.
Теллурид, селенид, фосфид, сульфид цинка — широко применяемые полупроводники.
Селенид цинка используется для изготовления оптических стёкол с очень низким коэффициентом поглощения в среднем инфракрасном диапазоне, например, в углекислотных лазерах.
На разные применения цинка приходится:
Мировое производство
Производство цинка в мире за 2009 год составило 11,277 млн т, что на 3,2 % меньше чем в 2008 г.[6]
Список стран по производству цинка в 2006 году (на основе «Геологического обзора Соединенных Штатов»)[7]:
| — | Весь мир | 10,000,000 |
| 1 | Китай | 2,600,000[8] |
| 2 | Австралия | 1,380,000 |
| 3 | Перу | 1,201,794 |
| 4 | США | 727,000 |
| 5 | Канада | 710,000 |
| 6 | Мексика | 480,000[8] |
| 7 | Ирландия | 425,700 |
| 8 | Индия | 420,800 |
| 9 | Казахстан | 400,000[8] |
| 10 | Швеция | 192,400 |
| 11 | Россия | 190,000 [8] |
| 12 | Бразилия | 176,000[8] |
| 13 | Боливия | 175,000[8] |
| 14 | Польша | 135,600 |
| 15 | Иран | 130,000[8] |
| 16 | Марокко | 73,000[8] |
| 17 | Намибия | 68,000[8] |
| 18 | Северная Корея | 67,000[8] |
| 19 | Турция | 50,000[8] |
| 20 | Вьетнам | 48,000[8] |
| 21 | Таиланд | 45,000[8] |
| 22 | Гондурас | 37,646 |
| 23 | Финляндия | 35,700 |
| 24 | ЮАР | 34,444 |
| 25 | Чили | 31,725 |
| 26 | Аргентина | 30,300[8] |
| 27 | Болгария | 17,300[8] |
| 28 | Румыния | 9,600[8] |
| 29 | Япония | 7,169 |
| 30 | Алжир | 5,000[8] |
| 31 | Саудовская Аравия | 1,500[8] |
| 32 | Грузия | 400[8] |
| 33 | Босния и Герцеговина | 300[8] |
| 34 | Мьянма | 100[8] |
Биологическая роль
| В этом разделе не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники. Эта отметка установлена 11 мая 2011. |
Цинк:
Содержание в продуктах питания
Среди продуктов, употребляемых в пищу человеком, наибольшее содержание цинка — в устрицах. Однако в тыквенных семечках содержится всего на 26 % меньше цинка, чем в устрицах. Например, съев 45 граммов устриц, человек получит столько же цинка, сколько содержится в 60 граммах тыквенных семечек. Практически во всех хлебных злаках цинк содержится в достаточном количестве и в легкоусваиваемой форме. Поэтому, биологическая потребность организма человека в цинке обычно полностью обеспечивается ежедневным употреблением в пищу цельнозерновых продуктов (нерафинированного зерна).
Содержание цинка:
Основные проявления дефицита цинка
Недостаток цинка в организме приводит к ряду расстройств. Среди них раздражительность, утомляемость, потеря памяти, депрессивные состояния, снижение остроты зрения, уменьшение массы тела, накопление в организме некоторых элементов (железа, меди, кадмия, свинца), снижение уровня инсулина, аллергические заболевания, анемия и другие [10].
Для оценки содержания цинка в организме определяют его содержание в волосах, сыворотке и цельной крови.
Токсичность
При длительном поступлении в организм в больших количествах все соли цинка, особенно сульфаты и хлориды, могут вызывать отравление из-за токсичности ионов Zn2+. 1 грамма сульфата цинка ZnSO4 достаточно, чтобы вызвать тяжелое отравление. В быту хлориды, сульфаты и оксид цинка могут образовываться при хранении пищевых продуктов в цинковой и оцинкованной посуде.
Отравление ZnSO4 приводит к малокровию, задержке роста, бесплодию.
Отравление оксидом цинка происходит при вдыхании его паров. Оно проявляется в появлении сладковатого вкуса во рту, снижении или полной потере аппетита, сильной жажде. Появляется усталость, чувство разбитости, стеснение и давящая боль в груди, сонливость, сухой кашель.
См. также
Ссылки
Примечания
| Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu, Th, Np, U, Hf, Be, Al, Ti, Zr, Yb, Mn, V, Nb, Pa, Cr, Zn, Ga, Fe, Cd, In, Tl, Co, Ni, Te, Mo, Sn, Pb, h3, W, Sb, Bi, Ge, Re, Cu, Tc, Te, Rh, Po, Hg, Ag, Pd, Os, Ir, Pt, Au |
dic.academic.ru
Для чего и зачем нужна покрытыя цинком сталь?

Покрытыя цинком сталь - это сталь, которая была обработана цинков. Цинк защищает сталь с 2-ух точек зрения. Во-1-х, он обладает высочайшей устойчивостью к коррозии, а железо, которое является главным компонентом стали, напротив, очень к ней восприимчиво. Слой цинка на поверхности стали предутверждает сталь от повреждений, которые она может очень стремительно получить, побыв под дождиком либо во увлажненной, кислородной среде. Процесс оцинкования также делает патину - слой оксидов цинка, слей и других соединений, который предоставляют стали дополнительную защиту. Цинка также очень прочен и устойчив к царапинам и имеет атласный вид, который многим кажется симпатичным.
Внешний слой цинка также работает как слой первой обороны. Если по некий причине ржавчина завладеет поверхностью покрытой цинком стали, то цинк получит коррозию сначала. Даже в поцарапанных областях, цинковая поверхность будет подвергаться коррозии до того, как сталь. Срок службы покрытой цинком стали варьируется, но промышленная арматура с покрытием цинка в слой чуток меньше мм может в состоянии выдержать без технического обслуживания более 70 лет.
Внедрение
Покрытую цинком сталь можно повстречать в почти всех областях жизни. Многие люди живут в домах со железными каркасами. В зданиях нередко делаются крыши из покрытой цинком стали. В авто находится огромное количество деталей из этого материала, также в морских судах. Огромное количество изделий для бытовой жизни, также детали и части разной продукции делают конкретно из покрытой цинком стали. Кроме того, что это дешевый, крепкий и действенный материал, его также можно использовать неограниченное число раз после переработки.
Недочеты
Гальванизация, процесс оцинковки стали, имеет ряд недочетов. Не все объекты можно оцинковать ввиду их размеров, и не все методы гальванизации идиентично эффективны. В конечном счете, цинк все таки подвергается коррозии, так что навечно он сталь от нее не защитит. Покрытыя цинком сталь, которую некорректно охлаждали, может иметь отшелушивающийся слой цинка.
Кандидатура гальванизации
Не все железные предметы можно идиентично отлично оцинковать. Покрытие из цинка будет очень толстым для маленьких винтов, к примеру. В почти всех случаях, нержавеющую сталь объединяют с хромов, заместо цинка.
Также советуем прочитать:
www.termoconnect.ru
Виды цинкования металла
Цинкование металла является самым популярным методом, цель которого – защита поверхности металла от негативного влияния, создаваемого коррозией. Этот метод применяется для многочисленных металлических изделий, к примеру, для железной посуды и деталей промышленных станков, для кузовных элементов автомобилей и канатов из проволоки, для железа в виде листов и телекоммуникационных проводов. Главным достоинством данного метода является его сравнительно недорогая цена и хорошие показатели эффективности.
Технологический процесс цинкования металла
Технология цинкования металла применима либо на полностью выровненных металлических поверхностях, либо на поверхностях, где имеется небольшой изгиб. Недопустимым условием данной технологии является наличие механических повреждений поверхности. Технологические требования относительно проведения процесса достаточно просты. Толщина слоя защитного покрытия может быть разной, ее определителем служит время всей рабочей операции и температура, при которой совершается процесс. При этом, показатель толщины не превышает 1,5 мм.
Процесс цинкования металла направлен на защиту от нежелательного влияния окисления. Для многих материалов, к примеру, алюминия, цинка и прочих, свойственно подвергаться окислению, просто находясь в воздушной среде. Тогда на их внешней поверхности возникает довольно плотная пленка, в основе которой – соединения металла, подвергшегося окислению. Данная плотная оболочка является надежной защитой от дальнейшего проникновения окисления внутрь материала. Железу эти свойства не характерны, потому окисление со временем может полностью уничтожить структуру материала. Чтобы уберечь железо и проводится цинкование.
Методы цинкования металла могут быть разными. В принципе, действие цинкования аналогично с защитой, образующейся от процесса лужения. Лужение проводится под действием другого материала – олова. Отличие этих двух процессов заметно лишь в случае, когда повреждается внешняя пленка, оберегающая железо. Лужение при механических или иных видах повреждений менее эффективно, так как оба материала являются не вполне надежной гальванической парой.
Виды цинкования металла
Виды цинкования металла - это методы нанесения покрытия, образующего надежную защитную пленку, состоящую из цинкового слоя. Современные технологии предусматривают наличие шести видов цинкования. Каждый из них отличается временем операции, свойствами, применяемым оборудованием и толщиной образующейся цинковой пленки.
Все классы цинкования металла достаточно легко перечислить. Цинкование может быть: газодинамическим, горячим и холодным, диффузионным, гальваническим. Также е перечню причисляется метод шоопирования. Шоопирование представляет собой обработку цинком, применяемым в расплавленном виде. При этом, на поверхность металла расплавленный цинк напыляется с применением специального пистолета. В газодинамическом методе слой наносится с помощью сверхзвукового потока.
Гальваническое цинкование металла - метод, проводимый в специальном барабане. Именно здесь запускается электрохимический процесс. В результате воздействия гальванического цинкования металлическая поверхность приобретает белый, голубой или радужный оттенок. Иногда возможен эффект создания матовой поверхности белого цвета. Такая пленка преимущественно наносится в декоративных целях, потому что сам слой имеет ничтожно малую толщину. При этом, основные адгезионные свойства довольно слабы.
Термодиффузионное цинкование металла - метод, осуществляемый под воздействием высоких температур. Температура подбирается соответственно марке стали, типа заготовки и прочих условий. Весь процесс занимает по времени от 1,5 до 3 часов, зависимо от того, какая при этом используется цинковая смесь, а также какая мощность у самой установки. Это цинковое покрытие имеет собственные преимущества, основным из которых является получение самой высокой твердости. Характерно, что при использовании данного метода, рабочая поверхность требует минимальной подговки перед началом процесса.
Горячее цинкование металла - метод, при котором металлические изделия окунаются в специальную ванну, где находится предварительно расплавленный цинк. Температура проведения операции составляет до 460 градусов Цельсия. В результате способа горячего цинкования металл приобретает замечательный адгезионные свойства, повредить которые не под силу незначительным трещинам или царапинам. Данный метод имеет низкую себестоимость, потому является одним из наиболее распространенных.
Холодное цинкование металла - наиболее легкий метод в отношении предварительной подготовки материала. Весь процесс заключается в том, что на поверхность металла наносятся специальные грунтовки или красители. Особенность таких покрытий в составе, так как он включает в себя около 98% цинковой пудры. В результате применения холодного метода цинкования металла, последний приобретает такое качество, как привлекательность внешнего вида. Также возникает гарантия надежной защиты от коррозии на достаточно продолжительный период времени.
Оборудование для цинкования металла может быть разным – все зависит от выбранного для проведения процесса метода. Стоит заметить, что процесс не канцерогенен, потому вполне подходит для проведения в любых производственных помещениях. Специальной подготовки, помимо установки оборудования, при этом не понадобится.
Метод горячего цинкования, прекрасно справляющийся с обеспечением металлической поверхности защиты от коррозии, является наиболее оптимальным по сравнению с другими способами относительно стоимости проведения. Именно этот метод наиболее часто используется различными промышленными предприятиями. Для его осуществления необходимо такое оборудование, как ванна для цинкования металла. Размеры данного оборудования могут быть разными. Именно от них зависит ограничение, выдвигаемое к размерам обрабатываемых изделий.
promplace.ru
Способы цинкования металла
Железо и сталь — это материал из которого изготовлен скелет современной технологической цивилизации. Но — увы! - и у стальной основы нашей цивилизации есть свое уязвимое место. Оно называется коррозия, от которой железо и сталь не имеют той естественной защиты, какой является оксидная пленка для многих цветных металлов — олова, цинка или алюминия.
Сталь нуждается в защите от коррозии - и лучшей защитой для нее будет цинкование. (или оцинковка). Оцинкованный лист прослужит гораздо дольше обычного стального.
Почему именно цинк?
Прежде всего потому, что цинк достаточно распространен и недорог, сам по себе коррозии практически не поддается, плавится при не очень высокой температуре (около 420 градусов, что гораздо ниже температуры плавления железа), обладает приемлемой прочностью. И при этом — что важно! - имеет стационарный электрический потенциал -0,76 В., то есть гораздо более отрицательный, чем у железа.
Благодаря этому своему свойству, цинк, даже при нарушении целостности покрытия и под воздействием электролитов, будет в возникающих электрохимических реакциях играть роль анода. То есть станет медленно растворяться, защищая этим от электрохимической коррозии стальную основу конструкции. В общем — даешь цинковые покрытия! Вот только какими способами их наносить? Это достаточно интересный вопрос, поскольку способов таких несколько — и у каждого из них есть свои плюсы и минусы. Рассмотрим их…
Горячее цинкование
Это самый, на первый взгляд, простой и надежный метод создания цинковой пленки на изделиях их чугуна и стали: эти предметы просто погружают в расплав цинка, а потом вынимают уже покрытыми слоем цинка толщиной от 40 до 80 микрон — то есть достаточно плотным и износостойким.

Однако не все так просто: для того, чтобы цинковая пленка надежно «зацепилась» на поверхности черного металла, эта поверхность должна быть тщательно очищена и офлюсована (то есть покрыта составом, который должен предотвратить ее окисление до соприкосновения с расплавом цинка, и обеспечить надежную адгезию цинковой пленки).
При этом нужно иметь в виду, что расплавленный цинк застывает довольно быстро и может поэтому образовывать наплывы до 1 мм. толщиной, что нежелательно в тех случаях, когда на поверхность оцинкованных изделий есть резьба. Кроме того, сама технология накладывает ограничения на размеры изделий, которые мы хотим оцинковать таким способом — они не могут быть больше, чем ванны с расплавом цинка (а они не могут очень большими по определению).
Холодный метод цинкования
 В отличии от горячего цинкования, его холодный вариант никак не связан с размерами цинкуемых деталей и поверхностей, поскольку он состоит в нанесении на них электролитических растворов цинка в различных летучих жидкостях. Такие растворы (гальванол, цинотан, цинотерн, цинкнол) наносятся на стальную поверхность из пульверизатора: растворитель высыхает, а цинковое покрытие остается — причем «садится» оно на поверхность стали очень надежно, с высокой адгезией. При этом покрываемую поверхность не нужно флюсовать, ее достаточно просто очистить от ржавчины и грязи.
В отличии от горячего цинкования, его холодный вариант никак не связан с размерами цинкуемых деталей и поверхностей, поскольку он состоит в нанесении на них электролитических растворов цинка в различных летучих жидкостях. Такие растворы (гальванол, цинотан, цинотерн, цинкнол) наносятся на стальную поверхность из пульверизатора: растворитель высыхает, а цинковое покрытие остается — причем «садится» оно на поверхность стали очень надежно, с высокой адгезией. При этом покрываемую поверхность не нужно флюсовать, ее достаточно просто очистить от ржавчины и грязи.
Холодный метод цинкования хорош своей простотой
и применимостью для работ на открытом воздухе. Но внешний вид покрытой таким способом стали будет просто матово-серым без металлического блеска.
Поэтому холодное цинкование лучше всего использовать как «покрытие под покраску».
Гальванический метод цинкования
Зато гальванический метод цинкования придает оцинкованой поверхности чрезвычайно привлекательный вид.
Он состоит в том, что через ванну с электролитом течет ток, причем анодом служат цинковые пластины, а катодом — изделия из стали. Под действием тока цинк растворяется в электролите, и его ионы оседают на железе. В результате получается тонкая (от 4 до 20 микрон) пленка, которая не только защищает сталь от коррозии, но и придает поверхности эстетичный внешний вид. Поверхность, покрытая гальваническим цинком может приобрести (в зависимости от своей толщины) сине-голубой, светло-серый или матово-белый металлический блеск. Главными достоинствами такого покрытия будет равномерность его толщины по всей покрываемой поверхности.
Но за этими плюсами идут и свои минусы: тонкое и красивое гальваническое покрытие будет не стойким к истиранию, а увеличение его толщины будет чревато тем, что сталь в процессе гальваники может приобрести заодно и т.н. «водородную хрупкость». Тем не менее, гальваническое цинкование. в силу своей малой себестоимости очень часто используется для антикоррозионной защиты разных видов крепежа, металлических изделий и декоративных элементов.
Термодиффузное цинкование
 Главного недостатка гальванического цинкования - «водородной хрупкости» позволяет избежать технология термодиффузионного цинкования.
Главного недостатка гальванического цинкования - «водородной хрупкости» позволяет избежать технология термодиффузионного цинкования.
Она основана на том, что цинк при определенных условиях может испаряться с поверхности цинксодержащего порошка и проникать в поверхностные слои железа, так что в результате образуется сложный сплав цинка с железом.
Такая диффузия становится возможной при
высокой (от 290 до 400 градусов) температуре и наличии электрического потенциала, при котором стальные изделия являются анодом.
Процесс термодиффузии производится во вращающемся контейнере при пониженном давлении (0,1 атмосферы) в восстановительной водородной атмосфере. На термодиффузное цинкование каждой партии крепежных метизов требуется от 90 до 180 минут.
 В результате эти детали приобретут мышино-серый цвет — но вместе с ним и повышенную прочность поверхности и отменную устойчивость к коррозии ( в 3-5 раз лучшую, чем при гальваническом цинковании и в полтора-два — чем при горячей оцинковке).
В результате эти детали приобретут мышино-серый цвет — но вместе с ним и повышенную прочность поверхности и отменную устойчивость к коррозии ( в 3-5 раз лучшую, чем при гальваническом цинковании и в полтора-два — чем при горячей оцинковке).
При этом равномерность покрытия будет идеальной, а про адгезию такого покрытия говорить и смысла нет — оно просто «сливается» с черным металлом, так что отделить ее от него просто невозможно. Конечно, внешний вид оцинкованных таким способом метизов, большого эстетического удовольствия не доставляет, но от болтов, гаек, пружин и шурупов особой красоты и не требуется.
Недостаток же у термодиффузного цинкования только один, но существенный — в силу особенностей технологии применять ее можно только в отношении небольших по размеру предметов.
Газо-термическая оцинковка
 В последнее время все более широко начинает использоваться еще один вариант нанесения цинкового покрытия — газо-термический. В этом случае цинк в виде тонкой проволоки или порошка подается к соплу специальной горелки, расплавляется в потоке раскаленного газа и мельчайшими каплями оседает на поверхность стального или чугунного изделия.
В последнее время все более широко начинает использоваться еще один вариант нанесения цинкового покрытия — газо-термический. В этом случае цинк в виде тонкой проволоки или порошка подается к соплу специальной горелки, расплавляется в потоке раскаленного газа и мельчайшими каплями оседает на поверхность стального или чугунного изделия.
В принципе, такой метод можно было бы считать разновидностью горячего цинкования, если бы только капли расплавленного цинка, ударяясь о поверхность металла не деформировались, создавая «чешуйчатое» пористое покрытие.
Такое покрытие требует дополнительного слоя краски для заполнения микропор в слое цинка.
Это, конечно, недостаток, но зато такие комбинированные покрытия отличаются отличной адгезией и обладают устойчивостью в самых неблагоприятных условиях эксплуатации (в морской воде, частых атмосферные осадках, кислой среде и т.д.), где они могут сохраняться до 30 лет.
Видео по теме:
stvybor.ru