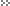- твердость,
- упругость,
- устойчивость к износу,
- выносливость.
- Низкоуглеродистые стали - 0,1-0,13 %
- Углеродистые стали 0,14-0,5%
- Высокоуглеродистые – от 0,6%
- в свободном - графит (в серых чугунах),
- в связанном - твердое состояние -цементит.
- теплоемкость;
- теплопроводность;
- модуль упругости.
- модуль сдвига (упругость при сдвиге) (G )– величина измеряемая в Паскалях (Па), определяющая упругие свойства тела или материала и их способность сопротивляться сдвигающим деформациям. Он применяется для расчета на сдвиг, срез, кручение.
- коэффициент линейного и коэффициент объемного расширения при изменении температуры – это величина показывающая относительное изменение линейных размеров или объема материала или тела при увеличении температуры при неизменном давлении.
- - прочность
- - твердость
- - пластичность
- - упругость
- - выносливость
- - вязкость
- степень окисления
- устойчивость к коррозии
- жаростойкость
- жаропрочность
- обыкновенного качества,
- качественная сталь,
- высококачественная сталь.
- Щелочные:
- Щёлочноземельные:
- Другие (которые зачастую не совсем правильно относят к щёлочноземельным):
- Переходные:
- Постпереходные:
- Тугоплавкие
- Металлы платиновой группы
- Цветные
- Благородные
- Монетные
- С кислородом реагируют все металлы, кроме золота и платиновых металлов. Реакция с серебром происходит при высоких температурах, но оксид серебра(II) практически не образуется, так как он термически неустойчив. В зависимости от металла на выходе могут оказаться оксиды, пероксиды, надпероксиды:
- С азотом реагируют только самые активные металлы, при комнатной температуре взаимодействует только литий, образуя нитриды:
- С серой реагируют все металлы, кроме золота и платины:
- С водородом реагируют только самые активные металлы, то есть металлы IA и IIA групп, кроме Be. Реакции осуществляются при нагревании, при этом образуются гидриды. В реакциях металл выступает как восстановитель, степень окисления водорода −1:
- С углеродом реагируют только наиболее активные металлы. При этом образуются ацетилениды или метаниды. Ацетилениды при взаимодействии с водой дают ацетилен, метаниды — метан.
- Когда атомы примеси намного меньше атомов металла-растворителя, растворенные атомы располагаются в решетке растворителя по междоузлиям, или «пустотам». Образование таких твердых растворов — твердых растворов внедрения — почти всегда сопровождается расширением решетки растворителя, и в окрестности каждого растворенного атома имеется локальное искажение решетки.
- Когда атомы примеси и растворителя имеют приблизительно одинаковые размеры, образуется твердый раствор замещения, в котором атомы растворенного элемента замещают атомы растворителя, так что атомы обоих сортов занимают места в узлах общей решетки. В таких случаях тоже вокруг каждого растворенного атома имеется искаженная область, а будет ли при этом решетка расширяться или сжиматься, зависит от относительных размеров атомов растворителя и растворенного вещества[11].
- ↑ Строго говоря из-за амфотерности химических свойств полуметаллы (металлоиды) представляют собой обособленную группу, не относясь ни к металлам, ни к неметаллам; К группе металлов их можно отнести лишь условно.
- ↑ Ranga P. Dias, Isaac F. Silvera Observation of the Wigner-Huntington transition to metallic hydrogen (англ.) // Science. — 2017-01-26. — P. eaal1579. — ISSN 1095-9203 0036-8075, 1095-9203. — DOI:10.1126/science.aal1579.
- ↑ In, Geology. Scientists Have Finally Created Metallic Hydrogen, Geology IN. Проверено 28 января 2017.
- ↑ Металлы // Энциклопедический словарь юного физика. / Сост. В. А. Чуянов. — М.: Педагогика, 1984. — с. 165—167. — 352 с.
- ↑ Ломоносов М. В. Основы металлургии и горного дела. — Санкт-Петербург: Императорская Академия Наук, 1763. — 416 с.
- ↑ Этимологический словарь русского языка. Вып. 10: М / Под общей редакцией А. Ф. Журавлёва и Н. М. Шанского. — М.: Изд-во МГУ, 2007. — 400 с. ISBN 978-5-211-05375-5
- ↑ Юрий Кукшкин. Химия вокруг нас
- ↑ (англ.) Los Alamos National Laboratory – Sodium. Архивировано 4 августа 2012 года.
- ↑ (англ.) Los Alamos National Laboratory – Aluminum. Архивировано 4 августа 2012 года.
- ↑ Поваренных А. С. Твердость минералов. — АН УССР, 1963. — С. 197-208. — 304 с.
- ↑ Юм-Розери, 1965, с. 92.
- ↑ Юм-Розери, 1965, с. 93-94.
- ↑ Юм-Розери, 1965, с. 97.
- ↑ Юм-Розери, 1965, с. 103.
- Инструкция
- Для получения стали необходимо выжигание лишнего углерода, так как после доменной плавки получают чугун, в котором углерода от 2,14 до 6,67%. Сталь содержит от 0,2 до 2,14% углерода. Достигается такой уровень углерода в мартеновской печи или в конвертере, где протекают химические реакции, свойственные получению сплава железа с углеродом.
- Углеродистые стали бывают низкоуглеродные, они используются в производстве сеток, тонколистового проката. Высокоуглеродистая сталь идет на изготовление инструмента, клинков, так она более прочная по сравнению с низкоуглеродистой. Чем выше содержание углерода в сплаве, тем выше твердость, но ниже ударная вязкость и пластичность. И высокоуглеродистый сплав отлично выдерживает динамические нагрузки, практически не подвержен окислению, износостойкий и легкий. Из него изготавливают детали машин, котлов, турбин, трубы, то есть все те комплектующие, что подвергаются высоким нагрузкам в процессе эксплуатации.
- Легированные стали не подвержены коррозии, это так называемые нержавеющие стали. В процессе выплавки к сплаву железо-углерод добавляются легирующие элементы, такие как хром, марганец, вольфрам, молибден, алюминий, и многие другие. Каждый элемент сообщает стали какое-либо новое качество, ей до этого не свойственное. Легирующие элементы ответственны за кристаллическую решетку сплава, поддерживают ее структуру, сообщая сплаву повышенную твердость, прочность, тугоплавкость. С добавлением ванадия, вольфрама и хрома получают быстрорежущую сталь, у которой очень высокая температурная устойчивость. Она идет для изготовления режущего инструмента, такого как сверла, перки, метчики, отрезные резцы, и т.д.
- Кроме легирования, для улучшения качеств стали применяются химические покрытия, такие как хромирование, цинкование. В отличие от легирования, когда дополнительные вещества используются в процессе выплавки стали, покрытия наносятся поверх готовой детали. Так делаются оцинкованные трубы, никелированные, хромированные. Покрытия на детали наносятся в специальных гальванических ваннах, электрохимическим или химическим способом. Детали для обработки погружаются при этом в специальный раствор.
Что такое сталь как химический элемент. Химический элемент сталь
Структура стали. Химические, механические и физические свойства.
Часть 1- "Cтруктура"
"Железо не только основа всего мира, самый главный металл окружающей нас природы, оно основа культуры и промышленности, оно орудие войны и мирного труда".
А.Е.Ферсман
Все знаю, что сталь является важнейшим инструментальным и конструкционным материалом для всех отраслей промышленности.
Металлургическая промышленность Украины насчитывает более 50 металлургических заводов и является стратегически важной для страны. В Украине производится широкий ассортимент металлопроката, таких, как: арматура, круги, квадрат, катанка, проволока, полоса, уголок, балка, швеллер, листы, трубы и метизы.
Сталь
Рассматривая данный вопрос, начнем с химического состава.
Сталь – это соединение железо (Fe) + углерод (С) + другие элементы растворенные в железе.
Железо в чистом виде имеет очень низкую прочность, а углерод ее повышает.
Углерод улучшает и некоторые другие показатели:
Содержание "Fe" в стали должно быть - не менее 45%, "С"- не более 2,14% - теоретически, однако на практике % концентрации углерода имеет следующий диапазон значений:
Чем выше процент содержания углерода в стали , тем выше ее прочность и меньше пластичность.
УГЛЕРОД - является неметаллическим элементом. Его плотность равна 2,22 г/см3, а плавится при t -3500 °С. В природе он присутствует 2х полиморфных модификаций – графит (стабильная модификация) и алмаз (метастабильная модификация), а в сплаве с железом:
Углерод в соединении с железом находится в состоянии цементита, т.е в химической связи с железом (Fe3C). Структура цементита может быть очень разной, а зависит она от процесса образования, содержания углерода и методов термообработок.
Углерод в свободном состоянии присутствует в сером чугуне (СЧ), в виде графита. Серый чугун имеет пористую металлическую структуру и является весьма хрупким; на нем легко появляются трещины (особенно в процессе сварки).
Химический состав углеродистых сталей обыкновенного качества (ГОСТ 380-71)
Система железо- углерод
Структура стали изучается по диаграмме состояния системы железо- углерод. Она характеризует структурные превращения стали и выражает зависимость структурного состояния от температурных режимов и химического состава.
Диаграмма состояния системы железо- углерод
Диаграмма состояния содержит критические точи, которые очень важны теоретически и практически для процессов термообработки стали и их анализа. С помощью диаграммы Fe-C - можно определить вид термообработки, температурный интервал изменения структуры и прогнозировать микроструктуру.
Структуры стали
Сплавы железа с углеродом при различных температурах и различном содержании «С» имеют различную структуру, а соответственно и физические и химические свойства. Одним из таких состояний и является описанный выше цементит. А теперь о них:
Аустенит – твердая структура углерода в гамма-железе - содержит "С" до 1,7% (t > 723° С). При снижении температуры аустенит распадается на феррит и цементит и возникает пластинчатая структура - перлит.
Феррит - твердый раствор "C" в α-железа- при t> 723-768° С , концентрация "С" составляет - 0,02%, а при t 20°С около 0,006% "С". Он очень пластичен, не тверд и имеет низкие магнитные свойства.
Цементит - карбид железа Fe3C. Концентрация «С» 6,63% . Цементит является хрупким , а его твердость - НВ760-800.
(на рисунке структура: цементит + перлит)
Перлит - механическая смесь феррита и цементита, образуемая при постепенном охлаждении в процессе распада аустенита. Исходя из размера частиц цементита перлит имеет различные механические свойства. Содержание «С» -0,8%.
(на рисунке структура: феррит + перлит)
Ледебурит (структура чугуна) - смесь образующаяся из кристаллизация жидкого сплава цементита и аустенита. Ледебурит очень твердый, но хрупкий. Концентрация "С"-4,3%
Свойства стали
Конечно, не только углерод влияет на свойства стали. Состав дополнительных элементов и их количество придают стали определенные свойства. Примеси бывают полезными и вредными. Хорошие примеси влияют исключительно на сами кристаллы, а вредные негативно воздействуют на связь кристаллов между собой. К хорошим примесям относят : марганец (Mn), кремний (Si). К плохим: фосфор (Р), серу (S), азот, кислород и другие.
Физические и механические свойства стали
Основными физическими свойствами стали являются:
Понятие модуля упругости стали (Е) заключается в соотношении твердого вещества упруго деформироваться при воздействии силы. Данная характеристика на прямую зависит от напряжения, а точнее, является производной соотношения напряжения к упругой деформации.
Основными механическими свойствами стали являются:
Показатели механических свойств углеродистых сталей обыкновенного качества ( ГОСТ 380-71)
Основными химическими свойствами стали являются:
Качество стали определяется различными показателями всех ее свойств и структуры. Учитываются и свойства и изделий из этой стали.
По качеству стали разделяют на:
В данной статье мы рассматриваем только структуру стали и связанные с ней понятия. Качество стали, состав дополнительных примесей и их свойства будут рассмотрены в следующей публикации.
Опубликовано: 24.12.2015
vikant.com.ua
Металлы — WiKi
Классификация
Из 118 химических элементов, открытых на данный момент, к металлам относят:
6 элементов в группе щелочных металлов: Li, Na, K, Rb, Cs, Fr
4 в группе щёлочноземельных металлов: Ca, Sr, Ba, Ra
а также вне определённых групп бериллий и магний
40 в группе переходных металлов:
— Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn;— Y, Zr, Nb, Mo, Tc, Ru, Rh, Pd, Ag, Cd;— La, Hf, Ta, W, Re, Os, Ir, Pt, Au, Hg;— Ac, Rf, Db, Sg, Bh, Hs, Mt, Ds, Rg, Cn;
7 в группе лёгких металлов: Al, Ga, In, Sn, Tl, Pb, Bi
7 в группе полуметаллов[1]: B, Si, Ge, As, Sb, Te, Po
14 в группе лантаноиды + лантан (La):Ce, Pr, Nd, Pm, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu
14 в группе актиноиды (физические свойства изучены не у всех элементов) + актиний (Ac):Th, Pa, U, Np, Pu, Am, Cm, Bk, Cf, Es, Fm, Md, No, Lr.
Также металлическими свойствами может обладать водород[2][3].
Таким образом, к металлам, возможно, относится 94 элемента из всех открытых; все остальные являются неметаллами.
В астрофизике термин «металл» может иметь другое значение и обозначать все химические элементы тяжелее гелия (см. Металличность).
Кроме того, в физике металлам, как проводникам, противопоставляется полупроводники и диэлектрики (см. также Полуметалл (спинтроника))[4].
Некоторые группы/семейства металлов
Аморфные металлы
Происхождение слова «металл»
Слово «металл» заимствовано из немецкого языка. Отмечается в «Травнике» Николая Любчанина, написанном в 1534 году: «…злато и серебро всех металей одолеваетъ». Окончательно усвоено в Петровскую эпоху. Первоначально имело общее значение «минерал, руда, металл»; разграничение этих понятий произошло в эпоху М. В. Ломоносова[5].
| Металлом называется светлое тело, которое ковать можно. Таких тел находим только шесть: золото, серебро, медь, олово, железо и свинец. Разделяются на высокие и простые металлы; которое разнство в том состоит, что высоких одним огнём без помощи других материй в пепел сожечь не можно, а напротив того простые через едину онаго силу в пепел обращаются.…За полуметаллы почитаются мышьяк, сурьма, висмут, цинк и ртуть. М. В. Ломоносов |
Немецкое слово «metall» заимствовано из латинского языка, где «metallum» — «рудник, металл». Латинское, в свою очередь, заимствовано из греческого языка (μεταλλον — «рудник, копь»).[6]
Нахождение в природе
Бо́льшая часть металлов присутствует в природе в виде руд и соединений. Они образуют оксиды, сульфиды, карбонаты и другие химические соединения. Для получения чистых металлов и дальнейшего их применения необходимо выделить их из руд и провести очистку. При необходимости проводят легирование и другую обработку металлов. Изучением этого занимается наука металлургия. Металлургия различает руды чёрных металлов (на основе железа) и цветных (в их состав не входит железо, всего около 70 элементов). Золото, серебро и платина относятся также к драгоценным (благородным) металлам. Кроме того, в малых количествах они присутствуют в морской воде и в живых организмах (играя при этом важную роль).
Известно, что организм человека на 3 % состоит из металлов[7]. Больше всего в организме кальция (в костях) и натрия, выступающего в роли электролита в межклеточной жидкости и цитоплазме. Магний накапливается в мышцах и нервной системе, медь — в печени, железо — в крови.
Производство металлов
Подготовка руды
Металлы извлекают из земли в процессе добычи полезных ископаемых. Добытые руды служат относительно богатым источником необходимых элементов. Для выяснения нахождения руд в земной коре используются специальные поисковые методы, включающие разведку и исследование рудных месторождений. Месторождения руд разрабатываются открытым или карьерным способом и подземным или шахтным способом. Иногда применяется комбинированный (открыто-подземный) способ разработки рудных месторождений.
После извлечения руд они, как правило, подвергаются обогащению. При этом из исходного минерального сырья выделяют один или несколько полезных компонентов — рудный концентрат(ы), промпродукты и отвальные хвосты. В процессах обогащения используют отличия минералов полезного компонента и пустой породы в плотности, магнитной восприимчивости, смачиваемости, электропроводности, крупности, форме зёрен, химических свойствах и др.
Работа с рудой
Из добытой и обогащённой руды металлы извлекаются, как правило, с помощью химического или электролитического восстановления. В пирометаллургии для преобразования руды в металлическое сырьё используются высокие температуры, в гидрометаллургии применяют для тех же целей водную химию. Используемые методы зависят от вида металла и типа загрязнения.
Когда металлическая руда является ионным соединением металла и неметалла, для извлечения чистого металла она обычно подвергается выплавлению — нагреву с восстановителем. Многие распространенные металлы, такие как железо, плавят с использованием в качестве восстановителя углерода. Некоторые металлы, такие как алюминий и натрий, не имеют ни одного экономически оправданного восстановителя и извлекаются с применением электролиза.[8][9]
Сульфидные руды не улучшаются непосредственно до получения чистого металла, но обжигаются на воздухе, с целью преобразования их в окислы.
Физические свойства металлов
Твёрдость
Все металлы (кроме ртути и, условно, франция) при нормальных условиях находятся в твёрдом состоянии, однако обладают различной твёрдостью. Ниже в таблице приводится твёрдость некоторых металлов по шкале Мооса.
Температура плавления
Температуры плавления чистых металлов лежат в диапазоне от −39 °C (ртуть) до 3410 °C (вольфрам). Температура плавления большинства металлов (за исключением щелочных) высока, однако некоторые «нормальные» металлы, например, олово и свинец, можно расплавить на обычной электрической или газовой плите.
Плотность
В зависимости от плотности, металлы делят на лёгкие (плотность 0,53 ÷ 5 г/см³) и тяжёлые (5 ÷ 22,5 г/см³). Самым лёгким металлом является литий (плотность 0.53 г/см³). Самый тяжёлый металл в настоящее время назвать невозможно, так как плотности осмия и иридия — двух самых тяжёлых металлов — почти равны (около 22.6 г/см³ — ровно в два раза выше плотности свинца), а вычислить их точную плотность крайне сложно: для этого нужно полностью очистить металлы, ведь любые примеси снижают их плотность.
Пластичность
Большинство металлов пластичны, то есть металлическую проволоку можно согнуть, и она не сломается. Это происходит из-за смещения слоёв атомов металлов без разрыва связи между ними. Самыми пластичными являются золото, серебро и медь. Из золота можно изготовить фольгу толщиной 0.003 мм, которую используют для золочения изделий. Однако не все металлы пластичны. Проволока из цинка или олова хрустит при сгибании; марганец и висмут при деформации вообще почти не сгибаются, а сразу ломаются. Пластичность зависит и от чистоты металла; так, очень чистый хром весьма пластичен, но, загрязнённый даже незначительными примесями, становится хрупким и более твёрдым. Некоторые металлы, такие, как золото, серебро, свинец, алюминий, осмий, могут срастаться между собой, но на это могут уйти десятки лет.
Электропроводность
Все металлы хорошо проводят электрический ток; это обусловлено наличием в их кристаллических решётках подвижных электронов, перемещающихся под действием электрического поля. Серебро, медь и алюминий имеют наибольшую электропроводность; по этой причине последние два металла чаще всего используют в качестве материала для проводов. Очень высокую электропроводность имеет также натрий, в экспериментальной аппаратуре известны попытки применения натриевых токопроводов в форме тонкостенных труб из нержавеющей стали, заполненных натрием. Благодаря малому удельному весу натрия, при равном сопротивлении натриевые «провода» получаются значительно легче медных и даже несколько легче алюминиевых.
Теплопроводность
Высокая теплопроводность металлов также зависит от подвижности свободных электронов. Поэтому ряд теплопроводностей похож на ряд электропроводностей, и лучшим проводником тепла, как и электричества, является серебро. Натрий также находит применение как хороший проводник тепла; широко известно, например, применение натрия в клапанах автомобильных двигателей для улучшения их охлаждения.
Наименьшая теплопроводность — у висмута и ртути.
Цвет
Цвет у большинства металлов примерно одинаковый — светло-серый с голубоватым оттенком. Золото, медь и цезий соответственно жёлтого, красного и светло-жёлтого цвета.
Взаимодействие с простыми веществами
На внешнем электронном уровне у большинства металлов небольшое количество электронов (1-3), поэтому они в большинстве реакций выступают как восстановители (то есть «отдают» свои электроны)
Реакции с простыми веществами
Чтобы получить из пероксида оксид, пероксид восстанавливают металлом:
Na2O2+2Na=2Na2O{\displaystyle {\mathsf {Na_{2}O_{2}+2Na=2Na_{2}O}}}Со средними и малоактивными металлами реакция происходит при нагревании:
3Fe+2O2=Fe3O4{\displaystyle {\mathsf {3Fe+2O_{2}=Fe_{3}O_{4}}}} 2Hg+O2=2HgO{\displaystyle {\mathsf {2Hg+O_{2}=2HgO}}} 2Cu+O2=2CuO{\displaystyle {\mathsf {2Cu+O_{2}=2CuO}}}При нагревании:
2Al+N2=2AlN{\displaystyle {\mathsf {2Al+N_{2}=2AlN}}} 3Ca+N2=Ca3N2{\displaystyle {\mathsf {3Ca+N_{2}=Ca_{3}N_{2}}}}Железо взаимодействует с серой при нагревании, образуя сульфид:
Fe+S=FeS{\displaystyle {\mathsf {Fe+S=FeS}}}Взаимодействие кислот с металлами
Электронное строение
Все металлы имеют слабую связь валентных электронов (электронов внешнего энергетического уровня) с ядром. Благодаря этому созданная разность потенциалов в проводнике приводит к лавинообразному движению электронов (называемых электронами проводимости) в кристаллической решётке. Совокупность таких электронов часто называют электронным газом. Вклад в теплопроводность, помимо электронов, дают фононы (колебания решётки). Пластичность обусловлена малым энергетическим барьером для движения дислокаций и сдвига кристаллографических плоскостей. Твёрдость можно объяснить большим числом структурных дефектов (междоузельные атомы, вакансии и др.).
Из-за лёгкой отдачи электронов возможно окисление металлов, что может приводить к коррозии и дальнейшей деградации свойств. Способность к окислению можно узнать по ряду активности металлов. Этот факт подтверждает необходимость использования металлов в комбинации с другими элементами (сплав, важнейшим из которых является сталь), их легирование и применение различных покрытий.
Для более корректного описания электронных свойств металлов необходимо использовать квантовую механику. Во всех твёрдых телах с достаточной симметрией уровни энергии электронов отдельных атомов перекрываются и образуют разрешённые зоны, причём зона, образованная валентными электронами, называется валентной зоной. Слабая связь валентных электронов в металлах приводит к тому, что валентная зона в металлах получается очень широкой, и всех валентных электронов не хватает для её полного заполнения.
Принципиальная особенность такой частично заполненной зоны состоит в том, что даже при минимальном приложенном напряжении в образце начинается перестройка валентных электронов, то есть течёт электрический ток.
Та же высокая подвижность электронов приводит и к высокой теплопроводности, а также к способности зеркально отражать электромагнитное излучение (что и придаёт металлам характерный блеск).
Структура металлов
Кристаллическая структура сплавов Вакансия в кристаллической решётке Образование дендритовНи один металл невозможно приготовить в абсолютно чистом состоянии. Технически "чистые" металлы могут содержать до нескольких процентов примесей, и если эти примеси являются элементами с низким атомным весом (например, углерод, азот или кислород), то в пересчете на атомные проценты содержание этих примесей может быть очень большим. Первые небольшие количества примесей в металле обычно входят в кристалл в виде твердого раствора. Можно выделить два главных типа твердых растворов.
Для большей части металлов наиболее важными элементами, образующими твердые растворы внедрения, являются водород, бор, углерод, азот и кислород. Присутствие дислокаций всегда приводит к появлению аномально больших или малых межатомных расстояний. В присутствии примесей каждая дислокация окружена «атмосферой» примесных атомов. Примесные атмосферы «закрепляют» дислокации, потому что в результате перемещения дислокаций будет образовываться новая конфигурация с повышенной энергией. Границы между кристаллами также являются областями с аномальными межатомными расстояниями и, следовательно, тоже растворяют примесные атомы легче, чем неискаженные области кристаллов.
При увеличении содержания примесей растворенные атомы входят и в основную массу кристалла, однако все еще имеется избыток примеси по границам зерен и вокруг дислокаций. Когда содержание примеси превышает предел растворимости, появляется новая фаза, которая может представлять собой или растворенное вещество, или промежуточную фазу, или соединение. В таких случаях границы между фазами могут быть двух родов. В общем случае кристаллическая структура частичек примеси слишком отлична от структуры металла-растворителя, поэтому решетки двух фаз не могут переходить одна в другую, образуя непрерывную структуру. В таких случаях на границах раздела фаз образуются слои с нерегулярной (искаженной) структурой. С образованием границ связано появление свободной поверхностной энергии, однако энергия деформации решетки растворителя относительно невелика. В таких случаях говорят, что эти частицы выделяются некогерентно.
B ряде случаев межатомные расстояния и кристаллическая структура металла-растворителя и частичек примеси таковы, что некоторые плоскости могут соединяться между собой, образуя непрерывную структуру. Тогда говорят, что частицы второй фазы выделяются когерентно и, поскольку сопряжение решеток никогда не бывает абсолютно точным, вокруг границы образуется сильно напряженная область. В тех случаях, когда энергия деформации слишком велика для этого, соседние кристаллы могут контактировать таким образом, что при этом в пограничных слоях возникают области упругой деформации, а на самой границе раздела — дислокации. В таких случаях говорят, что частицы выделяются полукогерентно[12].
При повышении температуры вследствие увеличения амплитуды колебаний атомов может образоваться дефект кристаллической решётки, который называют вакансия или "дырка". Диффузия вакансий является одним из механизмов образования дислокаций[13].
Как правило, кристаллизация металла происходит путём переохлаждения с образованием дендритной структуры. По мере разрастания дендритные кристаллы соприкасаются, при этом образуются различные дефекты структуры. В большинстве случаев металл затвердевает так, что первая порция кристаллов содержит меньше примесей, чем последующие. Поэтому, как правило, примеси концентрируются на границах зёрен, образуя стабильные структуры[14].
Применение металлов
Конструкционные материалы
Металлы и их сплавы — одни из главных конструкционных материалов современной цивилизации. Это определяется, прежде всего, их высокой прочностью, однородностью и непроницаемостью для жидкостей и газов. Кроме того, меняя рецептуру сплавов, можно менять их свойства в очень широких пределах.
Электротехнические материалы
Металлы используются в качестве хороших проводников электричества (медь, алюминий), так и в качестве материалов с повышенным сопротивлением для резисторов и электронагревательных элементов (нихром и т. п.).
Инструментальные материалы
Металлы и их сплавы широко применяются для изготовления инструментов (их рабочей части). В основном, это инструментальные стали и твёрдые сплавы. В качестве инструментальных материалов применяются также алмаз, нитрид бора, керамика.
История развития представлений о металлах
Знакомство человека с металлами началось с золота, серебра и меди, то есть с металлов, встречающихся в свободном состоянии на земной поверхности; впоследствии к ним присоединились металлы, значительно распространенные в природе и легко выделяемые из их соединений: олово, свинец, железо и ртуть. Эти семь металлов были знакомы человечеству в глубокой древности. Среди древнеегипетских артефактов встречаются золотые и медные изделия, которые, по некоторым данным, относятся к эпохе, удаленной на 3000—4000 лет от н. э.
К семи известным металлам уже только в средние века прибавились цинк, висмут, сурьма и в начале XVIII столетия мышьяк. С середины XVIII века число открытых металлов быстро возрастает и к началу XX столетия доходит до 65, а к началу XXI века — до 96.
Ни одно из химических производств не способствовало столько развитию химических знаний, как процессы, связанные с получением и обработкой металлов; с историей их связаны важнейшие моменты истории химии. Свойства металлов так характерны, что уже в самую раннюю эпоху золото, серебро, медь, свинец, олово, железо и ртуть составляли одну естественную группу однородных веществ, и понятие о «металле» относится к древнейшим химическим понятиям. Однако воззрения на их натуру в более или менее определенной форме появляются только в средние века у алхимиков. Правда, идеи Аристотеля о природе: образования всего существующего из четырёх элементов (огня, земли, воды и воздуха) уже тем самым указывали на сложность металлов; но эти идеи были слишком туманны и абстрактны. У алхимиков понятие о сложности металлов и, как результат этого, вера в возможность превращать одни металлы в другие, создавать их искусственно, является основным понятием их миросозерцания.
Лишь Лавуазье выяснил роль воздуха при горении и показал, что прибыль в весе металлов при обжигании происходит от присоединения к металлам кислорода из воздуха, и таким образом установил, что акт горения металлов есть не распадение на элементы, а, напротив, акт соединения, вопрос о сложности металлов был решен отрицательно. Металлы были отнесены к простым химическим элементам, в силу основной идеи Лавуазье, что простые тела суть те, из которых не удалось выделить других тел. С созданием периодической системы химических элементов Менделеевым элементы металлов заняли в ней своё законное место.
См. также
Примечания
Литература
Ссылки
ru-wiki.org
химический элемент, серебристо-белый металл, главная составная часть чугуна и стали, 6 букв, сканворд
химический элемент, серебристо-белый металл, главная составная часть чугуна и стали
Альтернативные описания• главный металл промышленности
• его куют, пока горячо и не отходя от кассы
• значение имени Тимур
• металл для Феликса
• химический элемент, металл
• чтобы избежать накопления денег, в древней Спарте деньги чеканились из этого материала
• так у компьютерщиков именуется сам компьютер, без программного обеспечения
• самым устойчивым элементом Периодической системы является именно этот элемент
• металл, из которого может быть «сделана» логика
• «иду в воду — красно, выйду — черно» (загадка)
• переведите с латинского слово «феррум»
• материал, из которого должен быть сделан подарок, преподнесенный к шестой годовщине свадьбы
• жертва ржавчины
• куй его, пока горячо!
• химический элемент, Fe
• металл, из которого сделан Феликс
• металлические части уздечки
• куется только сгоряча
• металл гвоздей
• ржавое, метеоритное
• куют, пока горячо
• куй ..., пока горячо
• в таблице он после марганца
• «куй ..., не отходя от кассы!»
• следом за марганцем в таблице
• металл номер двадцать шесть
• хим. элемент 26
• в таблице Менделеева оно под №26
• идущий следом за марганцем в таблице
• между марганцем и кобальтом
• предшественник кобальта в таблице
• металл для логики
• куй его, пока горячо (посл.)
• химический элемент 26
• вслед за марганцем в таблице
• основной компонент стали
• двадцать шестой в таблице Менделеева
• до кобальта в таблице
• принимают на металлолом
• материал для одной маски
• металл, чье содержание в организме женщины в пять раз больше, чем у мужчины
• перед кобальтом в таблице
• феррум
• последователь марганца в таблице
• между марганцем и кобальтом в таблице
• предтеча кобальта в таблице
• основной компонент чугуна
• после марганца в таблице
• металл для леди Маргарет Тэтчер
• последыш марганца в таблице
• следом за марганцем
• Химический элемент, серебристо-белый металл, главная составная часть чугуна и стали
• Главная составная часть стали
• Изделия из такого металла
• Лекарство, содержащее препараты такого химического элемента
• Наименование химического элемента
• Тип минерала, относящийся к самородным элементам
• "Куй ..., не отходя от кассы!"
• "иду в воду — красно, выйду — черно" (загадка)
• куй его, пока горячо
• металл, из которого может быть "сделана" логика
• переведите с латинского слово "феррум"
• ср. зале(и)зо южн. зап. металл, крушец, выплавляемый из руды в виде чугуна, и выковываемый из сего последнего под кричным молотом. соединении с углеродом, оно образует сталь. продажу железо идет в виде: полосового или сортового; первое прямо из под кричного молота; оно бывает: широкое, узкое, круглое, брусковое и пр. второе перековано: шинное, резное, листовое и пр. Ржа железо ест. Моль одежду, ржа железо, а худое братство нравы тлит. Деньги железо, а платье тлен. При рати железо дороже золота. Железом и золота добуду. Ржавое железо не блестит. Заруби деревом на железе. Что ощерился, аль железо увидал? огне и железо плавко. горну и железо надсядется. На то дорогу золотом устлали, чтоб она железо ела. Куй железо, пока кипит (пока горячо). Лезу я, лезу по железу на мясную гору? садиться на лошадь. Железо или мн. железа, вязи, оковы, кандалы, ножные, ручные цепи; железные конские путы. Железко, железце ср. железный обломок; мелкая железная, стальная вещь, вставляемая в какое-либо орудие или колодку, напр. копьецо стрелы, резец рубанка, железная часть долота и пр. Железный, из железа сделанный, почему-либо к железу относящийся; подобный железу по крепости, жесткости, цвету и пр. Железная руда, из которой добывается железо; железный завод, заведение, где оно выплавляется, выковывается; железный ряд, где оно продается железными торговцами. Железный сок, заводск. брызги и отломки от крицы, кричный сок. Железная лошадь, серо-железная, железного цвета, масти. Устюжна железная, а люди в ней каменные, за осаду ее при самозванцах. Железная дорога, железянка, чугунка. Железное колесо, тул. арктический пояс. Железные руки, сильные, но грубые и неуклюжие. Железный человек, стойкий, твердый; терпеливый, спорый; немилосердый, бездушный. Железное здоровье, крепкое. Либо железную цепь, либо золотую, добуду. Ссуды пишут на железной доске, а долги на песке. Железное дерево, бакаут, гваяк; назыв. так и др. весьма твердые тропической породы дерева. Железный корень, растен. Centaurea scabiosa. Железный урок или железное ср. стар. пеня, пошлина с виновного, в пользу властей, за наложение оков. Железовая лошадь, см. масть. Железистый прилаг. содержащий в себе железо. Железина, окал, окалина, гарь, огарки; железная, горелая блестка, осыпающаяся во время ковки. Кусок, полоса железа. Железня, железняга ж. арх. железная плиточка в ладонь, для игры в бабки, в козны; биток, битка. Железник м. дерево Caragana frutescens, дереза, чапыжник, ошибочно чилижник, сибирек? кустовая акация. Ракитник, дереза, Cytisus biflorus. Equisetum, хвощ столярный. Potentilla argentea, червичник, горлянка, забируха. Железница, рыба Clupea alosa, из рода сельдей, бешенка или верховодка. Железняк м. торговец железом. Общее название руд, содержащих окисленное железо и похожих видом на камень, а не на железо: бол. известны: бурый и магнитный железняк, магнитный камень. Самый твердый, лучший кирпич, несколько сплавившийся. Растен. Verbena offic. Растен. Phlomis pungens, качим, перекати-поле. Растен. Sarrothamnus scoparius, жерновец, дереза, бобровик. Сказочная разрывили спрыг-трава, от которой железные замки и запоры рассыпаются; ею же добывают и клады. Железнянка, см. железнянка, железа, желвь. Железоделательный, железодельный завод, железный, выделывающий железо из руды. Железоковательный, железоковный, относящийся до выковки железа в полосах и самых крупных вещах. Железоплавиленный, железоплавильный, железоплавный, относящийся к выплавке железа; завод, печь. Железорезный, служащий к резке железа;-завод, -стан
• химический элемент Fe
• химический элемент с позывным Fe
• DANKE
scanwordhelper.ru
СТАЛЬ - это... Что такое СТАЛЬ?
СТАЛЬ, сплавы ЖЕЛЕЗА с примесью УГЛЕРОДА. Исключительная прочность стали сделала ее чрезвычайно важным материалом в строительстве и производстве товаров. Наиболее распространенным видом является простая углеродная сталь, так как углерод является ее основной примесью. В такой стали содержится около 1% углерода и незначительные количества других компонентов (марганца, кремния, серы и фосфора). В ЛЕГИРОВАННОЙ СТАЛИ также содержится определенное количество углерода, но благодаря присутствию в них марганца, никеля, хрома, ванадия и молибдена, они обладают рядом индивидуальных свойств. Низколегированная сталь, в которой содержится менее 5% легирующих добавок, чрезвычайно прочна и используется в строительстве зданий, мостов и частей машин. В высоколегированной стали содержится более 5% добавок. Сюда относится НЕРЖАВЕЮЩАЯ СТАЛЬ. Впервые сталь научились производить около 2000 лет назад, но ранние МЕТОДЫ ее получения были медленными и трудоемкими, поэтому ее удавалось получить только в малых количествах. Широкомасштабное производство стали стало возможным лишь в середине XIX в., с изобретением БЕССЕМЕРОВСКОГО и МАРТЕНОВСКОГО ПРОЦЕССА. Сейчас при изготовлении стали используется КИСЛОРОДНОЕ ДУТЬЕ. Некоторые виды стали производят в ЭЛЕКТРОПЕЧИ ( в том случае, если в ее состав входят материалы, которые подверглись бы окислению в ходе других процессов производства стали).
Сталь На иллюстрации показано, как из железной руды получают обыкновенную углеродистую сталь, состоящую из чистого железа и незначительного количества углерода. В железной руде железо связано с кислородом и другими примесями, главным образом, кремнеземом. Обозначения: A) Полученное сырье — уголь, известняк и железная руда B) После первичного дробления и сортировки сырье обогащается. Уголь коксуется для того, чтобы удалить лишние вещества и примеси. Железная руда подвергается магнитному обогащению, чтобы отделить магнитную руду от немагнитной породы. Известняк обычно не содержит примесей C) Сырье дробится для того, чтобы его можно было использовать в домне D) Слишком крупное сырье возвращается для дальнейшего дробления, а подходящее для домны отправляется прямо туда. Слишком мелкая железная руда смешивается с мелким извесг-няком и коксом и сжигается для получения шлака Е) Известняк, железная руда и кокс продуваются горячим воздухом Топливная нефть сжигается при доменном дутье и воспламеняет кокс Сжигаемый кокс так сильно повышает тем пературу в центре домны, что материал в ней наполовину плавится. Горячий кокс и газы, которые образовались в результате сжигания, удаляют кислород из железной руды и образуют угарный и углекислый газы, — газообразную смесь,которая выводится через выхлопное отверстие Другая важная примесь в железной руде — это кремнезем, реагирующий с известняком. Освобожденные от кислорода железо и кремнезем собираются внизу печи. Смесь железо-кремнезем легче, чем железо, и образует слой шлака,тем самым способствуя их легкому разделению через разделяющие отверстия вверху F) Расплавленное железо поглощает лишний углерод из кокса, уровень которого должен быть понижен для того, чтобы получить годную к употреблению сталь Это происходит посредством продувания чистого кислорода по поверхности расплавленного магериала в домне. Углерод соединяется с кислородом и сгорает с образованием угарного и углекислого газов Извесшяк, скапливающийся на поверхносги расплавленного металла, поглощает много примесей, оставшихся после продувки G) Очищенная сталь с соответствующим содержанием углерода готова к разливке, а примеси остаются в шлаках
Научно-технический энциклопедический словарь.
dic.academic.ru
Содержание
Инструкция |
completerepair.ru
Условные обозначения химических элементов в марках сталей и их плотность.
Справочная информация
Условные обозначения основных элементов в марках металлов и сплавов и их плотность.
| Элемент | Символ | Черные Металлы | Цветные Металлы | Плотность, |
| г/куб.см | ||||
| Азот | N | A | - | 1,25 |
| Алюминий | Al | Ю | A | 2,69808 |
| Барий | Ba | - | Бр | 3,61 |
| Бериллий | Be | Л | - | 1,86 |
| Бор | В | Р | - | 2,33 |
| Ванадий | V | Ф | Вам | 6,12 |
| Висмут | Bi | Ви | Ви | 9,79 |
| Вольфрам | W | В | - | 19,27 |
| Гадолиний | Gg | - | Гм | 7,886 |
| Галлий | Ga | Гл | Гл | 5,91 |
| Гафний | Hf | - | Гф | 13,36 |
| Германий | Ge | - | Г | 19,3 |
| Гольмий | Но | - | ГОМ | 8,799 |
| Диспрозий | Dy | - | ДИМ | 8,559 |
| Европий | Eu | - | Eu | 5,24 |
| Железо | Fe | - | Ж | 7,87 |
| Золото | Au | - | Зл | 19,32 |
| Индий | In | - | Ин | 7,3 |
| Иридий | lr | и | И | 22,4 |
| Иттербий | Yb | - | ИТМ | 6,959 |
| Иттрий | Y | - | ИМ | 4,472 |
| Кадмий | Cd | Кд | Кд | 8,642 |
| Кобальт | Co | К | К | 8,85 |
| Кремний | Si | С | Кр | 2,3263 |
| Лантан | La | - | Ла | 6,162 |
| Литий | Li | - | Лэ | 0,534 |
| Лютеций | Lu | - | Люм | - |
| Магний | Mg | Ш | Мг | 1,741 |
| Марганец | Mn | Г | Мц(Мр) | 7,43 |
| Медь | Cu | Д | М | 8,96 |
| Молибден | Mo | М | - | 10,22 |
| Неодим | Nd | - | Нм | 7,007 |
| Никель | Ni | Н | Н | 8,91 |
| Ниобий | Nb | Б | Нп | 8,55 |
| Олово | Sn | - | О | 7,29 |
| Осмий | Os | - | Ос | 22,48 |
| Палладий | Pd | - | Пд | 12,1 |
| Платина | Pt | - | Пл | 21 |
| Празеодим | Pr | - | Пр | 6,769 |
| Рений | Re | - | Ре | 21,04 |
| Родий | Rh | - | Рд | 12,5 |
| Ртуть | Hg | - | Р | 13,5 |
| Рутений | Ru | - | Ру | 12,3 |
| Самарий | Sm | - | Сам | 7,53 |
| Свинец | Pb | - | С | 11,337 |
| Селен | Se | Е | СТ | 4,7924 |
| Серебро | Ag | - | Ср | 10,5 |
| Скандий | Sc | - | Скм | 2,99 |
| Сурьма | Sb | - | Су | 6,69 |
| Таллий | Tl | - | Тл | 11,85 |
| Тантал | Та | - | ТТ | 16,6 |
| Теллур | Те | - | Т | 6,25 |
| Тербий | Tb | - | Том | 8,253 |
| Титан | Ti | Т | ТПД | 4,505 |
| Тулий | Tu | - | ТУМ | 9,318 |
| Углерод | С | У | - | 2,2 |
| Фосфор | P | П | Ф | 1,83 |
| Хром | Cr | Х | Х(Хр) | 7,2 |
| Церий | Ce | - | Се | 6,768 |
| Цинк | Zn | - | Ц | 7,13 |
| Цирконий | Zr | Ц | ЦЭВ | 6,5 |
| Эрбий | Er | - | ЭРМ | 9,062 |
yaruse.ru
Сплавы железа - Популярная химия

Сплавами называют материалы, состоящие из нескольких химических элементов, из которых хотя бы один является металлом.
В металлургии железо и все его сплавы называют чёрными металлами.
Все сплавы железа разделяют на стали и чугуны.
В чистом виде железо слишком мягкое, поэтому для повышения прочности в него вводят углерод. И в зависимости от его содержания сплавы железа делятся на стали и чугуны. Если углерода в сплаве содержится более 2,14%, то такой сплав называется чугуном. А если менее 2,14%, то это сталь.
Чугун

Обычно чугун содержит 2,5-4% углерода, 0,2-1,5% марганца, 1-4,5% кремния, примеси фосфора и серы.
По своей структуре чугуны делятся на белые и серые.
В белых чугунах большая часть углерода находится в виде цементита (карбида железа Fe3C). Такие чугуны очень твёрдые и хрупкие. Применяют их для изготовления деталей и конструкций, не требующих дальнейшей обработки.
В серых чугунах углерод содержится в виде структурного свободного графита. В изломе такой чугун имеет серый цвет. Он хорошо сваривается и обрабатывается режущими инструментами.
Очень давно, когда чугун только научились получать, его считали отходом производства, так как из-за его хрупкости из него нельзя было ковать изделия. Но позже расплавленный чугун научились заливать в формы и стали получать готовые чугунные изделия: пушечные ядра, посуду, решётки и др.
Получают чугун в доменных печах из железной руды. В состав железной руды входят оксиды железа. При плавке происходит их восстановление углеродом. В результате получается расплавленный металл с высоким содержанием углерода (чугун) и шлаки. Так как плотность чугуна в 2,5 раза выше плотности шлака, то он легко отделяется от шлаков.
Чугун выпускают для дальнейшей переделки в сталь и для литейного производства в чугунолитейных цехах.
Из чугуна изготавливают детали двигателей, цилиндры, втулки, станины, решётки, люки, тормозные колодки и др.
Сталь

Сплав железа с углеродом, в котором углерода содержится не более 2,14%, называют сталью.
По своему химическому составу различают сталь углеродистую и сталь легированную.
Углеродистая сталь, кроме углерода, содержит примеси кремния, серы и фосфора. Эта сталь имеет низкие электротехнические свойства, невысокую прочность. Она теряет твёрдость и режущую способность уже при 200о С. Кроме того, она подвергается коррозии в агрессивных средах.
Для улучшения физических и химических свойств стали в неё добавляют элементы, которые называют легирующими. А сама сталь называется легированной. В процессе легирования в сталь добавляют вольфрам, хром, никель, молибден, ванадий, а также большое количество марганца и кремния. Так, марганец увеличивает твёрдость и прочность стали. Медь делает сталь устойчивой к коррозии. А никель и хром увеличивает вязкость. Легированная сталь не имеет недостатков, присущих углеродистой стали.
По количественному содержанию добавок легированную сталь делят на три группы: низколегированную, среднелегированную и высоколегированную. Низколегированная сталь содержит не более 2,5% добавок. Среднелегированная – от 2,5 до 10%. А в состав высоколегированной стали входит более 10% добавок. Высоколегированные стали различаются на нержавеющие, жаростойкие и жаропрочные стали.
На заре металлургии сталь получали из железной руды в плавильных горнах. Но оказалось, что гораздо проще и дешевле получать сталь из чугуна. Поэтому в современной металлургии чугун переплавляют в сталеплавильных печах, чтобы выжечь из него излишки водорода. И получают высококачественную сталь.
Сталь – прочный и пластичный материал. Её используют в металлических конструкциях зданий, мостов, в опорах линий электропередач, трубопроводах, резервуарах, в производстве арматуры, посуды, различного электрооборудования. Без стали невозможно представить кораблестроение, автомобилестроение, авиастроение и многие другие отрасли современной промышленности.

ximik.biz