-
Перед началом опыта наденьте защитные перчатки и очки.
-
Проводите эксперимент на подносе.
- Не допускайте попадания химических реагентов в глаза или рот.
- Не допускайте к месту проведения экспериментов людей без защитных очков, а также маленьких детей и животных.
- Храните экспериментальный набор в месте, недоступном для детей младше 12 лет.
- Помойте или очистите всё оборудование и оснастку после использования.
- Убедитесь, что все контейнеры с реагентами плотно закрыты и хранятся по правилам после использования.
- Убедитесь, что все одноразовые контейнеры правильно утилизированы.
- Используйте только оборудование и реактивы, поставляемые в наборе или рекомендуемые текущими инструкциями.
- Если вы использовали контейнер для еды или посуду для проведения экспериментов, немедленно выбросьте их. Они больше не пригодны для хранения пищи.
- В случае попадания реагентов в глаза тщательно промойте глаза водой, при необходимости держа глаз открытым. Немедленно обратитесь к врачу.
- В случае проглатывания промойте рот водой, выпейте немного чистой воды. Не вызывайте рвоту. Немедленно обратитесь к врачу.
- В случае вдыхания реагентов выведите пострадавшего на свежий воздух.
- В случае контакта с кожей или ожогов промывайте поврежденную зону большим количеством воды в течение 10 минут или дольше.
- В случае сомнений немедленно обратитесь к врачу. Возьмите с собой химический реагент и контейнер от него.
- В случае травм всегда обращайтесь к врачу.
- Неправильное использование химических реагентов может вызвать травму и нанести вред здоровью. Проводите только указанные в инструкции эксперименты.
- Данный набор опытов предназначен только для детей 12 лет и старше.
- Способности детей существенно различаются даже внутри возрастной группы. Поэтому родители, проводящие эксперименты вместе с детьми, должны по своему усмотрению решить, какие опыты подходят для их детей и будут безопасны для них.
- Родители должны обсудить правила безопасности с ребенком или детьми перед началом проведения экспериментов. Особое внимание следует уделить безопасному обращению с кислотами, щелочами и горючими жидкостями.
- Перед началом экспериментов очистите место проведения опытов от предметов, которые могут вам помешать. Следует избегать хранения пищевых продуктов рядом с местом проведения опытов. Место проведения опытов должно хорошо вентилироваться и находиться близко к водопроводному крану или другому источнику воды. Для проведения экспериментов потребуется устойчивый стол.
- Вещества в одноразовой упаковке должны быть использованы полностью или утилизированы после проведения одного эксперимента, т.е. после открытия упаковки.
-
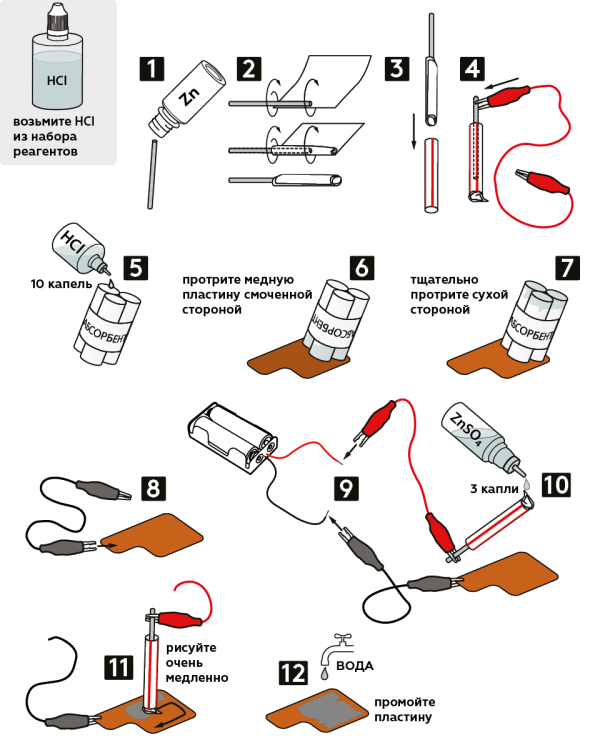
Возьмите кусочек проволоки из баночки с надписью «Zn».
-
Оберните его в тканевую салфетку, как показано на рисунке.
-
Аккуратно поместите завёрнутую проволоку в пластиковую трубочку, стараясь не оголить цинк.
-
Закрепите красный крокодил на цинковой проволоке.
-
Смочите абсорбент, добавив 10 капель 2М раствора соляной кислоты HCl.
-
Протрите медную пластину смоченной стороной абсорбента.
-
Тщательно протрите пластину сухой стороной абсорбента.
-
Закрепите чёрный крокодил на «ушке» медной пластины.
-
Подсоедините свободные концы крокодилов к держателю батареек: чёрный крокодил к чёрному проводу, красный – к красному. Вставьте держатель 2 батарейки «ААА».
-
Смочите салфетку 0.1М раствором сульфата цинка ZnSO4 (3 капли).
-
Рисуйте смоченной салфеткой очень медленно.
-
Промойте пластину водой. Вы получили серебряный рисунок на медной пластине!
Большая Энциклопедия Нефти и Газа. Пластины цинковые
Цинковая пластина - Большая Энциклопедия Нефти и Газа, статья, страница 1
Цинковая пластина
Cтраница 1
Цинковая пластина, обогащаясь электронами, приобретает отрицательный электрический заряд. Слой электролита, непосредственно прилегающий к пластинке, заряжается при этом положительно. Между пластинкой и раствором кислоты возникает разность потенциалов. Точно так же разность потенциалов возникает и между медной пластинкой и раствором кислоты, но меньшая по величине, чем у цинка. В результате разность потенциалов возникает между металлическими пластинками. [1]
Цинковая пластина, опущенная в раствор серной кислоты, будет растворяться в ней. Способность цинка легко отдавать свои электроны приводит к тому, что атом цинка, оставляя два своих электрона пластине, переходит в раствор в виде положительного иона. СьваниЧескийРОэле навливает дальнейшее растворение цинковой пластины. [2]
Цинковая пластина, опущенная в раствор серной кислоты, будет растворяться в ней. Способность цинка легко отдавать свои электроны приводит к тому, что атом цинка, оставляя два своих электрона пластине, переходит в раствор в виде положительного иона. Между цинковой пластиной и раствором возникает некоторая разность потенциалов, которая приостанавливает дальнейшее растворение цинковой пластины. [4]
Цинковая пластина, обогащаясь электронами, приобретает отрицательный электрический заряд. Слой электролита, непосредственно прилегающий к пластинке, заряжается при этом положительно. Точно так же разность потенциалов возникает и между медной пластинкой и раствором кислоты, но меньшая по величине, чем у цинка. В результате разность потенциалов возникает между металлическими пластинками. [5]
Цинковая пластина, выделяя электроны, заряжается отрицательно; поэтому пара Zn2 / Zn выполняет роль отрицательного электрода в элементе Даниэля, а пара Cu2 / Cu, принимающая электроны из внешней цепи, представляет положительный электрод элемента. [7]
Цинковые пластины не вполне пригодны для защиты конденсаторных трубок из латуни вследствие того, что они быстро теряют свою активность. Лучше ведут себя железные аноды. Продукты коррозии железа оказывают, по-видимому, также благоприятное влияние. Чугунные водяные камеры страдают от коррозии, выражающейся в виде графитации. [8]
Крайние цинковые пластины могут снабжаться углублениями, называемыми индикаторными окнами, с определенной толщиной в них металла. [10]
Отработанные цинковые пластины заменяются новыми, а отработанные медноокисные пластины могут быть восстановлены и вновь поставлены на работу. [11]
Наружные цинковые пластины элементов имеют две индикаторные панели, указывающие при разрушении соответственно 75 % и 100 % расхода емкости элемента. [12]
Периодически медные и цинковые пластины заменяют на новые, это обусловлено коррозией металлов в растворах щелочи или кислоты и увеличением хрупкости пластин при амальгамировании. [13]
Таким путем цинковая пластина образует отрицательный, а медная пластина - положительный полюс элемента Даниэля. [15]
Страницы: 1 2 3 4
www.ngpedia.ru
Цинковая пластина - Большая Энциклопедия Нефти и Газа, статья, страница 4
Цинковая пластина
Cтраница 4
Благодаря контакту между пластинами электроны-переходят С цинковой пластины на медную, а электрическая нейтральность в разных частях раствора поддерживается миграцией ионов. [46]
Фирма fchemotenex Geratebau для механического травления цинковых пластин выпускает нагану эмульсионного травления. [47]
Отрицательный электрод галетного элемента состоит из цинковой пластины с нанесенным на нее с одной стороны электропроводным слоем. С другой стороны на электроде располагают диафрагму. Диафрагма помещается на электрод не при сборке элемента, а во время изготовления цинкового электрода, поэтому изготовление и нанесение диафрагмы технологически связаны с операциями изготовления отрицательного электрода. [49]
Антикоррозионные устройства ( протекторы) в виде цинковых пластин и обручей устанавливаются в полостях охлаждения крышек цилиндров и вокруг втулок цилиндров для предохранения основных деталей от электрохимической коррозии, так как охлаждающая вода всегда является электролитом. Цинк, помещенный в электролит, меняет потенциал металлических поверхностей так, что ионы цинка переносятся на поверхности других деталей. [50]
По внешнему проводнику электроны будут переходить от цинковой пластины к медной. [51]
Исследованиями было установлено, что гладкая поверхность цинковых пластин действительно хорошо сопротивляется парафинизацпи в условиях скважины. [52]
Для предупреждения разъедания в котел вешается несколько луженых цинковых пластин и тогда разъедание сосредоточивается на цинке, потому что цинк является более электроотрицательным металлом, чем сталь. [53]
В результате вторичных реакций при электролизе на цинковой пластине выделяется атомарный кислород, на медной - атомарный водород. Затем эти атомы могут соединяться по два в молекулы соответствующих газов. [54]
После обжига копировальщик производит распределение краски на цинковых пластинах. Скребком освобождается рисунок соответствующей краски на ширину 8 - 10 мм, а потом вся поверхность вокруг рисунка вытравливается раствором шеллака в кислоте. Аналогично разделяют краски на всех остальных пластинах. Затем производят затравку цинковых пластин разбавленной азотной кислотой. [55]
Количественно эти процессы различны, потому что с цинковой пластины в раствор перейдет больше ионов, чем с медной пластины. Чтобы выявить это различие, опустим медную и цинковую пластинки в растворы их солей с концентрацией 1 г-ион / литр. [56]
Мелкие очищенные медные и латунные изделия укладывают на цинковую пластину и погружают в раствор для золочения. [57]
Оба раствора изолируются друг от друга диафрагмой, и цинковая пластина соединяется проводником с покрываемым изделием. [58]
При изготовлении цинковых электродов, как мы указывали выше, цинковые пластины подвергают вальцеванию, резке и штамповке. Все эти операции производят на стальных поверхностях и при нагревании. При выполнении их мельчайшие частички железа могут механически впрессовываться в поверхность цинка. Эти частички при соприкосновении цинка с раствором электролита вызывают коррозию цинка. [59]
Страницы: 1 2 3 4
www.ngpedia.ru
Оцинковка - MEL Chemistry
Безопасность
Общие правила безопасности
Информация о первой помощи
Рекомендации для родителей
Часто задаваемые вопросы
Для чего мы протираем медную пластинку соляной кислотой?
Чтобы цинк равномерно ложился на пластину, её нужно предварительно зачистить. Соляная кислота отлично обезжиривает поверхность для рисования и удаляет с неё различные загрязнения, благодаря чему получается красивый серебристый рисунок.
Не удаётся поместить обёрнутую цинковую проволоку в трубочку. Есть ли другой способ?
Разрежьте трубочку вдоль, вложите в неё проволоку и осторожно сомкните стенки импровизированной капсулы. Получилось? Отлично! А теперь закрепите красный крокодил на цинковой проволоке (шаг 4) и продолжайте эксперимент, следуя инструкции.
Рисунок получается чёрным. Что делать?
По всей видимости, вы очень быстро водили цинковой проволокой по пластине, и атомы не успели сформировать ровный блестящий слой. Чтобы попробовать снова, смочите абсорбент соляной кислотой и протрите пластину (только не забудьте потом протереть её сухой стороной абсорбента). Когда поверхность для рисования будет готова, водите по ней проволокой, но помните, что это нужно делать очень-очень медленно.
Попробуйте рисовать очень-очень медленно.
Пластинка не становится серебристой. Как это исправить?
Возможно, медная пластинка была плохо высушена от соляной кислоты. Снова протрите пластинку сухой стороной абсорбента. Добавьте ещё 2 – 3 капли ZnSO4 на ткань, оборачивающую проволоку, и рисуйте очень и очень медленно.
Если предыдущие действия не помогли, проверьте правильность соединения проводков в цепи. Красный крокодил должен крепиться к красному проводу держателя батареек, а чёрный – к чёрному.
Осмотрите батарейки: правильно ли они вставлены в держатель? Если полярность батареек соблюдена, попробуйте взять новые.
Другие эксперименты
Пошаговая инструкция
Утилизация
Утилизируйте твёрдые отходы эксперимента вместе с бытовым мусором.
Что произошло
Почему пластинка становится серебристой?
Это происходит потому, что в ходе эксперимента поверхность меди постепенно покрывает цинк – серебристый металл.
Узнать больше
Для того чтобы «прибыть» на поверхность меди и образовать на ней тонкий слой металла, большинству атомов цинка приходится преодолеть воистину гигантские по атомарным масштабам расстояния! Начиная от поверхности цинкового стержня, прорываясь сквозь хитросплетения смоченной в растворе сульфата цинка салфетки, упорно приближаясь к медной пластине и наконец-то оседая на ней.
Что же выступает двигателем для такого невероятного путешествия? Ответ на первый взгляд может показаться странным: энергия, заключённая в батарейках.
Под действием батареек электрический ток протекает по всей нашей системе: в проводах, соединяющих батарейки с медной пластиной и цинковым стержнем, а также в растворе сульфата цинка ZnSO4, находящемся в салфетке и связывающем их между собой.
Как именно цинк переходит с цинкового стержня на поверхность медной пластинки?
Как же электричество может способствовать переносу атомов цинка, которые являются частицами нейтральными, и, соответственно, чужими на этом празднике заряженных частиц?!
История происходящих с атомами цинка событий во многом напоминает ситуацию, описанную в опыте «Медяк» этого же набора. Переход цинка со стержня на пластину через раствор осуществляется за счёт так называемых электрохимических реакций – превращений вещества, возможных благодаря протеканию электричества.
Узнать больше
Батарейки заставляют цинковый стержень заряжаться положительно. В результате часть атомов цинка переходит в раствор в виде ионов цинка Zn2+:
Zn0 – 2e– → Zn2+
Так и начинается путешествие атомов цинка уже в виде ионов. Под действием электричества положительно заряженные ионы движутся от цинкового стержня (заряженного положительно) к медной пластинке, которая, напротив, несёт на себе избыточный отрицательный заряд. Материал салфетки, смоченной раствором сульфата цинка, нисколько не мешает этому продвижению: если для песчинок он может стать преградой, то против очень-очень-очень маленьких ионов цинка, он, естественно, бессилен.
Наконец ионы цинка прибывают к поверхности медной пластинки. И они с удовольствием бы осели на ней, вступив в электрохимическую реакцию и превратившись обратно в атомы цинка:
Zn2+ + 2e– → Zn0
Осели бы, если бы не стоящий на их пути оксид меди CuO!
Зачем протирать медную пластину раствором соляной кислоты HCl?
Именно так мы снимаем с медной пластинки тонкий слой оксидной плёнки CuO. Она не вступает в реакцию и не даёт ионам цинка подобраться к меди Cu0.
Узнать больше
Как же помочь ионам цинка добраться до заветной цели? Именно для этого необходимо самым тщательным образом протереть поверхность медной пластинки абсорбентом, смоченным раствором соляной кислоты HCl. В воде она полностью диссоциирует на положительно заряженные ионы водорода H+ и отрицательно заряженные ионы хлора Cl–. Ионы водорода способны превращать оксид меди в ионы меди Cu2+ и воду:
CuO + 2H+ → Cu2+ + h3O
Итак, путь для ионов цинка в таком случае свободен! Теперь они наконец могут удовлетворённо осесть на поверхности меди, образуя тонкий слой цинка и отдыхая в нём от своего головокружительного путешествия.
Это интересно
Для чего корабли и машины покрывают слоем цинка?
Оцинкование – способ защиты металлических, в первую очередь стальных изделий и деталей, из которых в основном состоит транспорт. При всех достоинствах железа, оно обладает важным недостатком – способностью со временем разрушаться под действием воздуха и влаги. Другие металлы (например, цинк) тоже немного окисляются на поверхности, но окислы эти в достаточной степени плотны, что препятствует дальнейшему разрушению металла. А вот в случае железа смесь оксидов и гидроксидов (или попросту ржавчина) представляет собой весьма рыхлый материал, который не способен защитить железо от дальнейшего окисления.
Чтобы предотвратить окисление железа, его покрывают различными материалами, в частности красками или другими металлами. Наиболее известными способами такой защиты являются оцинкование и лужение (покрытие оловом). В обоих случаях железо «закрывается» от окружающей среды слоем металла, устойчивого к воздействию воздуха и влаги благодаря плотности своего оксида.
Однако между оцинковкой и лужением есть принципиальное различие. Стоит лужёной стали только получить царапину, обнажающую стальную «начинку», как железо в этой области тут же начёт ржаветь, причём даже скорее, чем обычный (нелужёный) сплав. Это объясняется тем, что при контакте олова и железа возникает так называемая гальваническая пара: часть электронов «перетекает» к олову, что облегчает переход атомов железа на поверхности в форму катионов Fe2+. В случае же оцинкования происходит обратная ситуация: при соприкосновении цинка и железа электроны переходят на железо, замедляя процесс окисления. При этом самому цинку приходится «жертвовать собой», и он окисляется быстрее.
Существует несколько способов покрытия стальной детали цинком. Один из них – электролитическое оцинкование – по своему принципу абсолютно аналогичен тому, что происходило в опыте «Оцинковка»: деталь выступает в качестве отрицательно заряженного электрода (катода), на котором происходит восстановление ионов цинка из окружающего раствора и осаждение их в виде атомов на поверхности металла. Другой распространённый способ – погружение детали в расплавленный цинк (температура плавления около 460°) с последующим охлаждением на воздухе.
melscience.com
Цинковая пластина - Большая Энциклопедия Нефти и Газа, статья, страница 2
Цинковая пластина
Cтраница 2
Анодом служат цинковые пластины, катодом - изделия. Толщина покрытия колеблется в пределах 20 - 60 мк. Для повышения коррозионной стойкости цинковых покрытий применяют пассивирование в хромовых растворах. [16]
При погружении цинковой пластины в раствор на ней устанавливается некоторый компромиссный ( стационарный) потенциал фст характеризующийся равенством катодного тока ОА разряда ионов Н и анодного тока ОВ ионизации цинка. [18]
Наружная поверхность цинковой пластины покрыта слоем канифоли с частицами графита для электропроводности. [19]
В плоском элементе цинковая пластина покрыта слоем углерода, так что образуется сдвоенный ( двухслойный) электрод, который служит в качестве цинкового электрода для данного элемента и в качестве угольного для примыкающего к нему элемента. Элементы типа Mini-Max не имеют газовой расширительной камеры ( незаполненного объема) и угольного стержня, которые предусмотрены в круглых ( цилиндрических) элементах. Эта особенность дает возможность увеличить количество деполяризующей смеси, приходящейся на единицу объема элемента, и тем самым увеличить его энергоемкость. Кроме того, благодаря прямоугольной форме плоских элементов уменьшается объем бесполезного пространства при наборе батарей из таких элементов. [20]
Конструктивно протекторы представляют собой цинковые пластины размером 300 X 400 X Х15 мм. Вместо пластин можно использовать тонкие цинковые листы, собранные в пакет по 7 - 8 штук. Протектор с помощью болтов и про-волоки плотно прикрепляется к ба-ку испарителя. Цинковые пластины меняют 3 - 4 раза в год. [21]
Уход электронов с цинковой пластины нарушает равновесие между пластиной и раствором. Ионы цинка из двойного слоя отходят от пластины, а на их место с пластины идут в раствор новые ионы. В свою очередь уменьшение положительного заряда медной пластины позволяет подойти к ней новым ионам водорода. При соприкосновении с пластиной эти ионы получают электроны и превращаются в газообразный водород. Итак, при работе элемента Вольта на его положительном полюсе выделяется водород, а на отрицательном происходит растворение цинка. [23]
Уход электронов с цинковой пластины нарушает равновесие между пластиной и раствором. Ионы цинка из двойного слоя отходят от пластины, а на их место е пластины идут в раствор новые ионы. В свою очередь уменьшение положительного заряда медной пластины позволяет подойти к ней новым ионам водорода. При соприкосновении с пластиной эти ионы получают электроны и превращаются в газообразный водород. Итак, при работе элемента Вольта на его положительном полюсе выделяется водород, а на отрицательном происходит растворение цинка. Газообразный водород покрывает медную пластину и не дает ионам водорода разряжаться. [24]
Если на поверхности цинковой пластины прорезать канавки треугольного профиля, то при 0 sg 160 ртуть начинает растекаться. [26]
Машины для изготовления светочувствительных цинковых пластин для офсетной печати ( горизонтальные центрифуги), в общем случае имеющие электронагревательное устройство. [27]
В стакан 1 опускают цинковую пластину в стакан 2 - медную. [28]
Если, например, цинковую пластину, обернутую целлофаном, использовать в качестве катода яри электролизе цинкатного раствора, то через некоторое время после включения тока можно наблюдать в нижней части электрода осаждение рыхлого осадка дендритов цинка, сопровождающееся выделением пузырьков водорода на цинковом электроде. Однако существенным отличием является то, что образовавшийся на поверхности целлофана осадок цинка имеет довольно хороший контакт с самим катодом. Описанному явлению может быть дано следующее объяснение. [29]
В опыте по обнаружению фотоэффекта цинковая пластина крепится на стержне электрометра, предварительно заряжается отрицательно и освещается светом электрической дуги так, чтобы лучи падали перпендикулярно плоскости пластины. [30]
Страницы: 1 2 3 4
www.ngpedia.ru
Цинковые аноды Ц0
Цинковые аноды плоские и других форм.
 Нами производятся литые, холоднокатаные, а так же горячекатаные цинковые аноды. Для их изготовления используют четыре марки цинка, с маркировкой ЦВ, Ц0, Ц1С, Ц1, Ц0А. Используют растворимые цинковые аноды следующих типов:
Нами производятся литые, холоднокатаные, а так же горячекатаные цинковые аноды. Для их изготовления используют четыре марки цинка, с маркировкой ЦВ, Ц0, Ц1С, Ц1, Ц0А. Используют растворимые цинковые аноды следующих типов:- Пластины. Цинковые аноды в виде листа и подходят для всех видов электролитов. Свое применение нашли на маломасштабных производствах. Цинковые аноды из пластин имеют один существенный недостаток – загрузка в гальванику, к каждой пластине надо крепить контактный крюк.
- Сферы. Шарообразная, пулеобразная формы и т.п. Их удобнее загружать в гальванику.
Предельные отклонения цинковых анодов варьируются: по толщине от -0,4 мм до -1,1 мм при номинальной от 5 мм до 20 мм; по ширине от -10 мм до -20 мм при номинальной от 65 мм до 600 мм; по длине -20 мм при номинальной от 400 мм до 1200 мм. Аноды производят с градацией 25мм по ширине и 50мм по длине.
Пример условного обозначения: Анод ГПРХХ 10Х500Х1000 Ц0 ГОСТ 1180-91 (анод, размеры, из цинка марки Ц0).
Теоретический вес цинковых анодов можно рассчитать, исходя из того, что плотность цинка 7,2 кг/дм3. Один цинковый анод весит 34,56 кг при размерах 10Х500Х1000 мм. На практике же вес цинковых анодов может быть до 37 кг. Допускается волнистость анода, цинковые аноды с двумя необрезанными кромками.
Цинковые аноды транспортируют без упаковки всеми видами крытых транспортных средств. Упаковываются под заказ. Пачка цинковых анодов весит 1250 кг (транспортный пакет максимальной массы). Хранят цинковые аноды в закрытых помещениях защищенных от механических повреждений, активных химических веществ, влаги.
Наша организация – производитель цинковых анодов, готова предложить весь спектр цинковых анодов всех типоразмеров и форм. Если вы используете цинковые аноды в пластинах, мы рекомендуем попробовать цинковые аноды сферические нашего производства, они позволяют повысить удобство использования и выход готовой продукции. Продажа цинковых анодов это наш конек. Цинковые аноды купить вы можете у нас, отправив заявку на сайт или позвонив по телефону.
russkijmetall.ru
Цинковая пластина - Большая Энциклопедия Нефти и Газа, статья, страница 3
Цинковая пластина
Cтраница 3
Отрицательным полюсом элемента Лекланше является цинковая пластина, а положительным - графитовый стержень. Электролитом 22.3. Элемент служит раствор нашатыря в воде, а деполяриза - Лекданше. [31]
Отрицательным полюсом элемента Лекланше является цинковая пластина, а положительным - графитовый стержень. Электролитом служит раствор нашатыря, в воде, а деполяризатором-двуокись марганца МпО, которая смешивается с графитовым порошком и спрессовывается вокруг графитового стержня. [32]
Было установлено, что на цинковые пластины действуют лишь ультрафиолетовые лучи. Тонкая стеклянная пластинка, введенная на пути возбуждающего света, нацело исключала эффект. [33]
При ремонте щелочных наливных элементов отработанные цинковые пластины заменяют новыми, отработанные медноокисные восстанавливают и вновь ставят. Восстановление этих пластин может производиться до 4 - 5 раз. При смене пластин заменяют также электролит. [34]
Явление фотоэффекта обнаруживается при освещении цинковой пластины, соединенной со стержнем электрометра. [35]
Отрицательный электрод галетного элемента представляет собой цинковую пластину 2, на которую нанесен электропроводящий слой 1 из графита со связующим. Электролит 3 имеет пастообразную консистенцию. Афишная бумага 5 предохраняет элемент от межэлектродных замыканий кусочками отколовшейся от брикета 4 положительной массы. Поливинилхлоридное кольцо 6 обеспечивает герметичность элемента. [37]
Отрицательный электрод галетного элемента представляет собой цинковую пластину 2, на которую нанесен электропроводящий слой / из графита со связующим. Электролит 3 имеет пастообразную консистенцию. Афишная бумага 5 предохраняет элемент от межэлектродных замыканий кусочками отколовшейся от брикета 4 положительной массы. Поливинилхлоридное кольцо 6 обеспечивает герметичность элемента. [39]
В галетном элементе отрицательным электродом является цинковая пластина, положительным - спрессованный в виде галеты порошок диоксида марганца с углем. Между электродами помещают картонную пластинку, пропитанную раствором нашатырного спирта. Наружная поверхность цинковой пластины покрыта слоем канифоли с частицами графита для электропроводности. В качестве изоляции используют хлорвиниловые пленки. Галетные элементы компактны, и их активные материалы ( уголь и особенно цинк) используются лучше, чем в стаканчиковых элементах. [41]
В галетном элементе отрицательным электродом является цинковая пластина, положительным - спрессованный в виде галеты, порошок двуокиси марганца с углем. Между электродами помещают картонную пластинку, пропитанную раствором нашатыря. В качестве изоляции используют хлорвиниловые пленки. Га летные элементы более компактны, чем стаканчиковые. [42]
В галетном элементе отрицательным электродом является цинковая пластина, положительным - спрессованный в виде галеты порошок двуокиси марганца с углем. [44]
Отрицательный электрод галетного элемента состоит из цинковой пластины с нанесенным на нее с одной стороны электропроводным слоем. С другой стороны на электроде располагается диафрагма. Диафрагма помещается на электрод не при сборке элемента, а во время изготовления цинкового электрода, поэтому изготовление и нанесение диафаргмы технологически связаны с операциями изготовления отрицательного электрода. [45]
Страницы: 1 2 3 4
www.ngpedia.ru
Катодная защита цинковыми анодами - Справочник химика 21
В грунтах, обладающих достаточно высокой электропроводностью, наиболее эффективным методом защиты металлических конструкций является электрохимическая защита как дополнение к изолирующим покрытиям или как самостоятельный способ защиты. Широкое применение в технике для защиты подземных металлических сооружений находит катодная поляризация (катодная защита), в результате которой потенциал сооружения смещается в отрицательную сторону, а скорость коррозии снижается. Катодная защита может быть осуществлена в двух вариантах с использованием внешних источников тока (аккумуляторных батарей, селеновых выпрямителей, генераторов постоянного тока) и путем применения протекторов из металлов с потенциалом, более отрицательным, чем у стали. Такими металлами являются магний, цинк и алюминий. При присоединении протектора к трубопроводу образуется гальванический элемент, катодом которого является стальной трубопровод, а анодом — магниевый или цинковый электрод. Электрохимическая защита подробно рассматривается в гл. XIX. [c.196] Для предотвращения коррозии металлических конструкций, находящихся в почве, таких как металлические трубопроводы, резервуары, сваи, опоры, применяется электрохимическая катодная защита. Ее осуществляют путем подсоединения металлической конструкции к отрицательному полюсу внешнего источника постоянного тока, положительный полюс присоединяют к заземленному металлическому электроду, который постепенно разрушается. При этом на поверхности защищаемого металла протекают восстановительные процессы, а окисляется материал анода. Другой метод электрохимической защиты основан на присоединении защищаемого металла к электроду, изготовленному из более активного металла. При защите стальных конструкций применяют цинковые пластины. В этой гальванической паре цинк будет разрушаться и защищать сталь от коррозии. Отсюда и название этого метода —метод протектора (от лат. рго ес/ог —покровитель). Например, для защиты от коррозии к корпусам морских кораблей прикрепляют цинковые пластины. [c.149]Катодная защита — способ противодействия коррозии путем предотвращения растворения железа по уравнению (7.31). Для защиты стальных конструкций используют либо приносимый в жертву гальванический анод, изготовленный из металла, расположенного левее защищаемого металла в ряду напряжений, либо электролитический анод, присоединенный к внешнему источнику постоянного тока. Магниевые или цинковые гальванические аноды взаимодействуют с железом наподобие аккумулятора таким образом, что они корродируют и постепенно разлагаются, тогда как стальная конструкция, с которой они соединены, оказывается защищенной от коррозии. Системы такого типа обычно применяют для защиты небольших нагревательных котлов. [c.215]
Особенно широкое применение в технике находит катодная поляризация (катодная защита), в результате которой потенциал сооружения смещается в отрицательную сторону, а скорость коррозии снижается. Катодная защита может быть осуществлена в двух вариантах с использованием внешних источников тока (аккумуляторных батарей, селеновых выпрямителей, генераторов постоянного тока) и путем применения протекторов из металлов с потенциалом более отрицательным, чем сталь. Такими металлами являются магний, цинк и алюминий. При присоединении протектора к трубопроводу образуется внутренний источник постоянного тока — гальванический элемент, катодом которого является стальной трубопровод, а анодом магниевый или цинковый протектор. [c.93]
Кадмиевое покрытие, так же как и цинковое, применяется главным образом для защиты черных металлов от коррозии. Однако, если цинковое покрытие почти при всех условиях является анодным, то кадмиевое покрытие в одних условиях может быть анодным, а в других — катодным. В растворах, содержащих хлориды, кадмий является анодом по отношению к железу. Поэтому кадмиевые покрытия могут применяться для защиты изделий, работающих в морских условиях. Этому благоприятствует также и го обстоятельство, что кадмий химически устойчивее цинка. [c.170]В агрессивных растворах, в морской воде, в почве применяют электрохимический метод защиты. Одной из разновидностей этого метода является метод протекторной защиты, который применяют в нейтральных средах. К стальной конструк-дии 1 присоединяют пластины из чистого цинка 2 или сплава цинка с алюминием (рис. 92). При этом образуются макро-гальванические элементы, в которых цинк (или сплав цинка) выполняет функцию анода, а конструкция, которую защищают от коррозии, становится катодом. При этом цинковые пластины (протектор) растворяются, а коррозия конструкции (катода) вследствие сдвига электродного потенциала в более отрицательную область прекращается или сильно уменьшается. Другая разновидность электрохимического метода — катодная защита. Конструкцию 1 для защиты от коррозии присоединяют к отрицательному полюсу генератора постоянного тока, положительный полюс — к куску железа 2 (рис. 93). Это сдвигает потенциал защищаемой конструкции в область более отрицательных значений, что приводит к сильному торможению коррозии. [c.376]
Катодная защита цинковыми анодами [c.168]
Пять работ были посвящены в основном методам катодной защиты нержавеющих сталей. В двух случаях предпочтение было отдано цинковым протекторам [252, 253]. В третьей работе проведено сравнение анодов из цинка, алюминия, железа и магния [254]. В четвертом случае рассмотрена система катодной защиты с наложенным током [255]. Наконец, в работе [256] было показано, что углеродистая сталь может слух ить эффективным протектором защита нержавеющей стали при полном погружении обеспечивалась в течение более 8 лет, а на среднем уровне прилива — в течение 16 лет. [c.204]
При катодной защите подземных резервуаров-хранилищ с помощью протекторов обычно применяют магниевые протекторы, поскольку цинковые протекторы имеют слишком малое движущее напряжение (см. раздел 7.2.2). Достигаемая величина защитного тока h при использовании протекторов зависит от движущего напряжения Ut, действующего между объектом катодной защиты и протекторами (анодами), а также от сопротивления растеканию тока в грунт с объекта защиты R и с протекторов Ra [см. формулу (7.13)]. Поправками на расстояние между протекторами и на сопротивление подводящих проводов можно пренебречь, и защитный ток составит [c.272]
Катодная защита относится к активным видам защиты оборудования, находящегося во влажной почве или в воде. Применяют протектор, т. е. разрушающийся анод, например цинковый (рис. 14), при растворении которого возникает электрический ток, необходимый для катодной поляризации защищаемого оборудования, или источник постоянного тока (рис. 15), отрицательный полюс которого подключается к защищаемому оборудованию, а положительный — к вспомогательному аноду, например графитовому. Анод располагают на расстоянии от защищаемого оборудования. Потенциал защищаемого металла смещается к более отрицательным значениям и достигает области иотенциалов термодинамической устойчивости (области защиты). Для катодной защиты стали в почве и нейтральных водных растворах минимальный потенциал составляет — 770- —780 мВ. [c.40]
Таким образом, катодная защита высокопрочных сталей представляет большую опасность, особенно, когда сталь является очень прочной и соответственно сильно напряженной фактически в этих случаях неразумно использовать цинковые или алюминиевые аноды-протекторы и губительно наложение внешнего тока. Для низкопрочных сталей могут быть использованы цинковые аноды, но каждая система при этом должна рассматриваться индивидуально. [c.265]
Для борьбы с электрохимической коррозией иногда используют метод катодной защиты. Его сущность заключается в создании такой гальванической пары, в которой стальные стенки аппарата являются катодом, не разрушающимся в процессе электролиза. Например, в стальном аппарате размещают пластинку из металла, составляющего гальваническую пару с железом и являющегося в ней анодом (цинк и др.) в этом случае разрушению будет подвергаться цинковая пластинка, а не стенка аппарата. [c.88]
Рабочий потенциал цинка по отношению к катодно защищаемой стали равен 200— 250 мВ, что значительно меньше потенциала магния (700 мВ). Такая величина потенциала цинка идеальна для морской воды или других электролитов с низким удельным электрическим сопротивлением, но применение цинка в средах с более высоким удельным сопротивлением не всегда оправдано. Например, использование цинка не даст, по-видимому, существенного эффекта при защите больших подземных систем в почвах с высоким удельным сопротивлением. В то же время цинк оказался полезным материалом для защиты небольших подземных конструкций (таких как резервуары), помещенных в почву с удельным сопротивлением менее 3000 Ом-см. В работе Оливе [19] обсуждается применение цинковых анодов для защиты подземного оборудования на бензоколонках в США. Более крупные системы, насчитывающие значительное число цинковых анодов, созданы для защиты стальных газовых магистралей в Хьюстоне и Новом Орлеане [20]. Из общего числа защитных анодов, равного 1200, почти 1000 — цинковые. Это является хорошим примером, показывающим, что при соответствующих почвенных условиях цинковые аноды можно использовать для защиты крупных подземных сооружений. Цинк довольно широко применяют для защиты труб малого диаметра, не имеющих защитных покрытий, а в последнее время его начинают все чаще использовать для защиты труб большого диаметра с покрытиями в зонах плотной застройки, что позволяет уменьшить взаимное коррозионное влияние соседних подземных коммуникаций. Цинковые аноды применяют также для защиты оцинкованных резервуаров для холодной воды. [c.168]
Проекты катодной защиты кабельных оболочек или труб при помощи постороннего источника реализуются время от времени в различных странах мира с переменным успехом. Заставляют проходить ток по оболочкам (или трубам) в качестве катодов через почву к анодам, в качестве которых могут служить или специальные трубы, или пластины, закопанные в землю, или рельсы, с которых опасный ток уходит каким-либо другим путем. Это последнее обстоятельство, конечно, увеличивает коррозию рельсов, но не обязательно в большой степени. Катодная защита распространена до некоторой степени в Японии для стальных труб. В случае свинцовых кабельных оболочек, которые в Японии корродируют больше всего в колодцах, найдено, что погружение цинковой пластинки (50 в воду, находящуюся в колодце и электрически присоединенную к свинцовой оболочке, часто дает защиту. Цинк является анодом короткозамкнутой цепи и подверг- [c.45]
В 1824 г. Хэмфри Дэви [2], основываясь на данных лабораторных исследований в соленой воде, сообщил, что медь можно успешно защитить от коррозии, если обеспечить ее контакт с железом или ЦИНКОМ. Он предложил осуществлять катодную защиту медной обшивки кораблей с использованием прикрепленных к корпусу жертвенных железных блоков при соотношении поверхностей железа и меди I 100. При практической проверке скорость коррозии, как и предсказывал Дэви, заметно уменьшилась. Однако катодно защищенная медь обрастала морскими организмами в отличие от незащищенной меди, которая образует в воде ионы меди в концентрации, достаточной для уничтожения этих организмов (см. разд. 5.6.1). Так как обрастание корпуса уменьшает скорость судна во время плавания. Британское Адмиралтейство отвергло эту идею. После смерти X. Дэви в 1829 г. его двоюродный брат Эдмунд Дэви- (профессор химии Королевского Дублинского университета) успешно защищал железные части буев с помощью цинковых брусков, а Роберт Маллет в 1840 г. специально изготовил цинковый сплав, пригодный для использования в качестве жертвенных анодов. Когда деревянные корпуса судов были вытеснены стальными, установка цинковых пластин стала традиционной для всех кораблей Адмиралтейства . Эти пластины обеспечивали местную защиту, особенно от усиленной коррозии, вызванной контактом с бронзовым гребным валом. Однако возможность общей катодной защиты морских судов не изучалась примерно до 1950 г., когда этим занялись в канадском военно-морском флоте [3]. Было показано, что при правильном применении препятствующих йбрастанию красок и в сочетании с противокоррозионными красками катодная защита кораблей возможна и заметно снижает эксплуатационные расходы. Катодно защищенные, а следовательно, гладкие корпуса уменьшают также расход топлива при движении кораблей. [c.216]
Важным фактором, влияющим на скорость коррозии и электрохимические характеристики металлов, является температура. Повышение температуры раствора увеличивает скорость коррозии металлов. Интересно, что на разные металлы повышение температуры влияет по разному. Так, если при нормальной комнатной температуре железо является катодом по отношению к цинку, то при температуре более 75° С происходит изменение полярности в паре и цинк становится катодом по отношению к железу. Этим обстоятельством объясняется неудачное применение цинкового покрытия для защиты стальных радиаторов водяного отопления в связи с пористостью катодного цинкового покрытия наступает сквозное проржавление стенки радиатора, являющегося анодом в гальванопаре железо — цинк при повышенных температурах. [c.44]
Цинковые аноды должны помещаться в оболочку из гипса и бентонита, смешанных в равных пропорциях. Открытая конструкция анода уменьшает риск блокировки тока продуктами коррозии, однако какая бы ни применялась оболочка, невозможно устранить образование пленки, препятствующей прохождению тока на обычных цинковых анодах, содержащих примеси. Только с некоторого времени, когда стали применять цинковые аноды специального состава, такое применение цинка для катодной защиты получило значительный интерес. [c.267]
Для защиты погруженных конструкций (в морской или солоноватой воде) нельзя применять неорганические цинковые покрытия в сочетании с системами катодной защиты (без дополнительных покровных слоев другого состава). Это относится также к окраске трюмной части судов, защищаемых протекторными анодами. [c.322]
Например, цинковое покрытие является анодом по отношению к стали в атмосферных условиях и полностью предотвращает образование на ней ржавчины при отсутствии большой незащищенной площади. Из-за расхода анодного покрытия в местах несплошности площадь незащищенного основного слоя постепенно возрастет и плотность катодного тока, который уже является низким, уменьшится. Через определенное время плотность тока становится недостаточной для предотвращения коррозии в центре увеличенной площади незащищенной поверхности основного слоя металла, и он начинает корродировать на этом участке. Анодная защита продолжает оказывать действие на внешние участки незащищенной поверхности основного металла, которые расположены ближе к большим анодным участкам покрытия. [c.51]
Поверхность металла изолируют от коррозионной среды путем покрытия их другими металлами, лаками, красками, эмалями, битумами, пластмассами, маслами. На некоторых металлах формируют окисные, фосфатные, сульфидные пленки, которые затем пропитывают маслами или другими гидрофобными наполнителями. Металлические покрытия делятся на катодные и анодные. К катодным относят покрытия, которые при коррозии являются катодом. Это металлы, у которых равновесный потенциал больше, чем у защищаемого металла. Так, например, медное покрытие на цинке является катодом, так как медь растворяется при более положительном потенциале, чем цинк. В гальванической паре медь — цинк медь является катодом. К анодным относятся покрытия, являющиеся в паре с защищаемым металлом анодом (цинковое покрытие на лелезе). При этом при повреждении цинкового покрытия потенциал коррозии железа окажется отрицательнее равновесного потенциала лелеза. Цинк будет растворяться, а на железе будет протекать катодная реакция. При этом железо не растворяется. Защита электрическим током делится на катодную и анодную защиту. В первом случае потенциал защищаемого металла смещают от потенциала коррозии до равновесного потенциала данного металла. При равновесном потенциале металла коррозионный ток равен нулю. Для этого изделия катодно поляризуют внешним током. [c.229]
НОМ составе сплава. В последнем случае а поверхности сплава быстро образуется слой продуктов коррозии, состоящих главным образом из карбонатов щшка, который обладает высоким сопротивлением и этим резко уменьшает выход тока. Этой причиной часто объясняется неэффективность катодной защиты цинковыми анодами. Образование пленки на поверхности цинка может быть сильно заторможено, если засыпать ано1ды смесью, состоящей главным образом из гипса (сульфата кальция). С еще большим успехом образование пленки может быть предотвращено путем применения цинка высокой чистоты (99,99%). Наиболее вредной примесью цинка является железо, содержание которого в цинке не должно превышать 0,0014%. [c.315]
Из поляризационной диаграммы медно-цинкового элемента (рис. 4.2) видно, что если за счет внешней поляризации сместить потенциал цинка до потенциала анода при разомкнутой цепи, то потенциал обоих электродов будет одинаков и цинк не будет корродировать. На этом основана катодная защита металлов — эффективный практический способ свести коррозию к нулю (этот вопрос рассмотрен в гл. 12). Внешний ток прилагают к корроди- [c.68]
Площадь основного металла, на которую распространяется катодная защита, зависит от электропроводимости среды. В центре трехмиллиметрового дефекта в цинковом покрытии по стали, помещенной, например, в дистиллированную или мягкую воду (с низкой электропроводимостью), может наблюдаться ржавление основного металла. Однако в морской воде, которая является хорошим проводником, сталь защищается цинком на расстоянии в несколько дециметров от края цинкового покрытия. Такое различие в поведении обусловлено тем, что в электропроводящей среде плотность тока, необходимая для катодной защиты, обеспечивается на значительном расстоянии, в то время как в среде с низкой электропроводимостью плотность катодного тока быстро падает по мере удаления от анода. [c.233]
Некоторые специалисты выразили скептическое отношение к результатам этих исследований. Еще в 1935 г. в одной из работ Американского института нефти в Лос-Анжелесе утверждалось, что токи от цинковых анодов (протекторов) на сравнительно большом расстоянии уже не могут защитить трубопровод и что защита от химического воздействия (например кислот) вообще невозможна. Поскольку в США вплоть до начала текущего столетия трубопроводы нередко прокладывали без изоляционных покрытий, катодная защита для них была сравнительно дорогостоящей и для ее осуществления требовались значительные токи. Поэтому естественно, что хотя в США в начале 1930-х гг. и защищали трубопроводы длиной около 300 км цинковыми протекторами защита катодными установками (катодная защита током от постороннего источника) обеспечивалась только на трубопроводах протяженностью до 120 км. Сюда относятся трубопроводы в Хьюстоне (штат Техас) и в Мемфисе (штат Теннесси), для которых Кун применил катодную защиту в 1931—1934 гг. Весной 1954 г. И. Денисон получил от Ассоциации инженеров коррозионистов премию Уитни. При этом открытие Куна стало известным вторично, потому что Денисон заявил На первой конференции по борьбе с коррозией в 1929 г. Кун описал, каким образом он с применением выпрямителя снизил потенциал трубопровода до — 0,85 В по отношению к насыщенному медносульфатному электроду. Мне нет нужды упоминать, что эта величина является решающим критерием выбора потенциала для катодной защиты и используется теперь во всем мире . [c.37]
Это общее утверждение впрочем не означает, что сплавы со сте-хиометрической потерей материала от коррозии совершенно непригодны для изготовления заземлителей на станциях катодной защиты. Иногда в качестве материала для анодных заземлителей применяют даже железный лом кроме того, при электролитической обработке воды используют алюминиевые аноды (см. раздел 21.3). Цинковые сплавы находят применение как материал для анодов лри электролитическом травлении для удаления ржавчины, чтобы предотвратить образование гремучего хлорного газа на аноде. Для внутренней защиты резервуаров при очень низкой электропроводности содержащейся в них воды на магниевые протекторы иногда накладывают ток от внешнего источника с целью увеличить токоотдачу (в амперах) (см. раздел 21.1). По так называемому способу Кателько наряду с алюминиевыми анодами (протекторами) намеренно устанавливают медные, чтобы наряду с защитой от коррозии обеспечить также и предотвращение обрастания благодаря внедрению токсичных соединений меди в поверхностный слой. Впрочем, все такие области применения являются сугубо специальными. На практике число материалов, пригодных для изготовления анодных заземлителей, сравнительно ограничено. В основном могут применяться следующие материалы графит, магнетит, ферросилид с различными добавками, сплавы свинца с серебром, а также так называемые вентильные металлы с покрытиями из благородных металлов, например платины. Вентильными называют металлы с пассивными поверхностными слоями, не имеющими электронной проводимости и сохраняющими стойкость даже при очень положительных потенциалах, например титан, ниобий, тантал и вольфрам. [c.198]
На крупных резервуарах для питьевой воды тоже была применена катодная защита от коррозии с наложением тока от постороннего источника. На башенном резервуаре емкостью 1500 м после 10 лет эксплуатации были обнаружены дефекты в хлоркаучуковом покрытии в виде коррозионных язв глубиной до 3 мм. После тщательного ремонта с нанесением нового покрытия в виде двухкомпонентной грунтовки с цинковой пылью и двух покрывных слоев из хлоркаучука была смонтирована система катодной защиты с наложением тока от постороннего источника [7]. С учетом требуемой плотности защитного тока для стали без покрытия в 150 мА-м и доли площади пор 1 % защитная установка была настроена на отдачу тока в 4 А. Чтобы учесть изменения в потребляемом защитном токе в зависимости от уровня воды в резервуаре, предусмотрели два контура с наложением защитного тока. Один, предназначаемый для подвода тока к донному аноду, можно было настраивать на постоянное значение тока вручную. Другой контур обеспечивал питание электродов у стен и работал с регулированием потенциала. В качестве материала для ан да была применена титановая проволока с платиновыми покрытиями и медным подводящим проводом. Донный кольцевой анод имел длину 45 м. Аноды у стен были размещены на высоте 1,8 м, причем анод у внутренней стены имел длину 30 м, а анод у наружной стены — 57 м. Для регулирования потенциала использовали электроды сравнения из чистого цинка, которые имеют в питьевой воде сравнительно стабильный потенциал. Крепежные штыри для анодов и электродов сравнения были изготовлены из поливинилхлорида. [c.387]
Протекторы (гальванические аноды) для размещения в грунте выполняют преимущественно из магния. Впрочем, при удельном электросопротивлении грунта менее 20 Ом-м могут быть экономичными также и цинковые протекторы, имеющие больший срок службы. В табл. 22.1 приводится сопоставление затрат на катодную защиту магниевыми протекторами при общей величине токоотдачи 100 мА и различном электросопротивлении грунта. В зависимости от фактического сопротивления грунта соответственно варьировали размеры протекторов или [c.415]
Цинк. Системы катодной защиты с цинковыми протекторами очень эффективны. К достоинствам таких систем относятся простота, доступность анодов с высоким коэффициентом полезного использования снлава и, что особенно важно, способность к саморегуляции. Контур, в котором используется цинковый протектор, должен обладать малым сопротивлением, с тем чтобы через анод мог протекать достаточно сильный ток, необходимый для поляризации. Для цинковых протекторов характерна высокая токоотдача (А-ч на единицу объема). Лакокрасочные и другие защитные покрытия не испытывают воздействия высоких локальных потенциалов в отличие от систем, использующих магниевые протекторы. [c.171]
Использование магниевых анодов, удовлетворяющих спецификации MIL-A-2I412A, цинковых анодов, удовлетворяющих спецификации MIL-A-18001H, или алюминиевых анодов с подходящими свойствами позволяет легко обеспечить надежную катодную защиту конструкций в морской воде. Удовлетворительными электрохимическими свойствами обладают протекторы из сплава алюминия с небольшими добавками цинка и ртути, однако токоотдача тагах анодов может существенно снижаться в анаэробных донных отложениях, покрытых водой. [c.204]
В этом случае металл был поляризован до значения потенциала-анода и не мог бы корродировать. Это может быть достигнуто путем катодной поляризации защищаемого металла с по-мощь10 внешнего источника постоянного тока (катодная защита), либо с помощью тока, получаемого при создании контактной пары (протекторная защита). Поляризацию катода можно увеличить с помощью так называемых ингибиторов коррозии (например, Са (НСОз)2, N2h5, ЫааЗОз) Другой способ — анодные металлические покрытия (цинковые, алюминиевые, кадмиевые), широко используемые в борьбе с коррозией стали в морской воде. [c.48]
Максимальную разность потенциалов относительно стальной катодно-защищенной поверхности можно получить при использовании протекторов из магниевых сплавов ( 0,6 В). Поэтому основной областью применения магниевых литых протекторов является защита подземных металлических сооружений в грунтах с удельным сопротивлением р 50 Ом-м. Стержневые магниевые протекторы используются в грунтах с удельным сопротивлением рморской воде (рмагниевые протекторы имеют токоотдачу до 1 А. Основная область применения алюминиевых анодов — катодная защита в морской воде. Разность потенциалов относительно стальной катодно-защищенной поверхности невелика ( 0.3 В). Основная область применения цинковых протекторов — в морской воде, однако цинковые аноды с активатором могут с успехом применяться [c.278]
В протекторные покрытия входят наполнители (например, цинковый порошок), являющиеся по отношению к стали растворимыми анодами, обеспечивающими катодную защиту, Ме-таллизацнонные покрытия из металлов, анодных по отношению к подложке (цинка и алюминия), а также комбинированные (эти же покрытия, пропитанные лакокрасочными материалами), действуют и как изолирующие, и как протекторные. [c.7]
Для защиты от коррозии применяют также различные защитные неметаллические (разные лаки, краски, полимерные материалы, масла) и металлические покрытия. Металлические покрытия разделяют на анодные и катодные. Анодные покрытия защищают металл не только механически, но и электрохимически. В порах, например, цинкового покрытия на железе при образовании микрогальваноэлемента цинк является анодом, а железо — катодом (рис. 90). Цинк растворяется в электролите, а железо не будет разрушаться до тех пор, пока сохраняется цинковое покрытие. [c.375]
Цинк должен иметь потенциал —1,05 В относительно Си/Си304, а по отношению к катодно защищаемой стали рабочий (защитный) потенциал будет примерно равен —0,25 В. Таким образом, потенциал достаточно отрицателен для использования цинка в качестве расходуемого анода. Впервые он был применен с этой целью еще более ста лет назад для защиты медной обшивки корпусов военных кораблей. Однако первые попытки закрепить цинковые аноды на стальных корпусах судов окончились полным провалом. Единственной причиной этого было непонимание первостепенной важности чистоты цинка. Присутствие даже небольших количеств некоторых примесей вызывает образование на поверхности цинка плотных пленок с хорошей адгезией, делающих аноды неактивными. [c.168]
Катодная защита для предупреждения электролитической коррозии находит также широкое применение. Проводится значительная работа по сравнению различных анодов. В настоящее время 50 холодильников и один насос снабн 0ны магниевыми анодами, другие шесть насосов с платиновыми анодами и селеновым выпрямителем находятся под наблюдением. Дно резервуара для хранения керосина (или газойля) защищено от морской воды катодной установкой с цинковыми анодами. [c.26]
В результате лабораторных экспериментов в морской воде Хамфри Дэви [1] обнаружил в 1824 г., что медь можно полностью защитить от коррозии контактированием с железом или цинком. Он рекомендовал применять катодную защиту кораблей с медной обшивкой с использованием жертвенных анодов из железа, которые присоединялись к корпусу отношение поверхности железа к меди рекомендовалось приблизительно 1 100. При практическом осуществлении этого способа, как и предсказывал Дэви, скорость коррозии медной обшивки значительно снизилась, однако защищенная катодной поляризацией медь обрастала морскими организмами. Незащищенная медь, при растворении которой на поверхности создается достаточная концентрация ионов меди для отравления таких организмов, не обрастает ими. Поскольку обрастание уменьшало скорость судов в плавании. Британское адмиралтейство отвергло это предложение. После смерти X. Дэвн в 1829 г. его двоюродный брат Эдмунд Дэви (профессор химии в Королевском Дублинском университете) с успехом защищал изготовленные из железа бакены присоединением к ним цинковых брусков, а Роберт Маллет в 1840 г. создал цинковый сплав, пригодный для изготовления жертвенных анодов . После того как деревянные корпуса судов были заменены стальными, присоединение цинковых плит вошло в практику эксплуатации всех адмиралтейских судов. Это обеспечивало локальную защиту, особенно против влияния контакта с бронзовым винтом. [c.172]
Поэтому катодная защита обычно используется ири коррозии в электролитах с кислородной деполяризацией. Диаграмма, иллюстрирующая электрозащиту, представлена на рпс.20, а защиту ири помощи анодного протектора, т.е. более эффективного анода, чем защищаемый металл, на рис.21. Диаграмма на рис.21 для случая защиты жедеза цинковым протектором построена аналогично представленной на рис.8. Электрический контакт железа с цинком приводит к увеличению 1р7п и снижению 1рРе практически до 0. [c.54]
Значительная часть сортамента и изделий из низкоуглеродистых сталей покрывается цинком. Цинк аноден по отношению к железу, и когда влага проникает до основного металла, цинк корродирует, обеспечивая защитное действие, которое прекращается, когда обнажается такая поверхность стали, что поляризующее действие цинка становится недостаточным (обычно в центре обнаженного участка стальной подложки). Наиболее важным фактором защиты является количество цинка в слое. Защитная способность осадка определяется в основном его толщиной, а не способом нанесения. Защитные свойства цинковых покрытий на железе основаны не только на способности цинка функционировать.в качестве расходуемого анода, которая имеет определенные границы, но также и на блокировании участков коррозии, которое происходит в результате соединения ионов цинка с гидроксильными ионами, образующимися вследствие катодной реакции на поверхности железа и осаждения образующейся гидроокиси внутри мелких несплош- [c.150]
Защитить металл от коррозии можно не только покрывая его другим металлом, но и связывая его проводником с металлом, корродирующим более сильно. Чтобы понять сущность этого метода, вспомним, например, что коррозию железа вызывают возникающие на его поверхности локальные элементы, на анодах которых и происходит растворение (гл. V, 4). Действие таких локальных элементов можно подавить, если железный предмет, соприкасающийся с влажной почвой, водой или раствором соли, связать проводником с одним или несколькими цинковыми или магниевыми листами (рис. 39). Данные металлы обладают отрицательным, большим по абсолютной величине стандартным электрохимическим потенциалом, чем железо, и при их присоединении начинает действовать гальванический элемент, катодом которого является железо, а анодом — цинк или магний. Так как напряжение на этом гальваническом элементе намного больше, чем на локальных элементах на поверхности железа, различие между анодными и катодными участками последних исчезает, следовательно, прек- [c.289]
На рис. XIII. 5 приведена блок-схема автоматической катодной станции AEI Morgan на тиристорах. Используют линейные аноды и цинковые ЭС. Выпускают модификации с максимальным выходным током 80 и 120 а. Точность регулирования потенциала + 10 мв. Назначение отдельных элементов ясно из рис. XIII. 5. Усилитель имеет малый дрейф и коэффициент усиления 1000. Предусмотрена быстродействующая токовая защита. [c.202]
chem21.info